

I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Nella seconda metà dell'Ottocento Maxwell e Boltzmann riuscirono a formulare una descrizione coerente del comportamento della materia e dell'energia applicando una teoria chiamata Meccanica Statistica.
Il presupposto alla base della meccanica statistica è che, essendo i sistemi materiali composti da un numero enorme di elementi (atomi o molecole), non è possibile , per ragioni pratiche, applicare alle singole particelle le leggi della meccanica classica, calcolando per ciascuna la posizione, la velocità e l'energia di ciascuna particella. Pur tuttavia rimane possibile descrivere tali sistemi prendendo in considerazione i valori medi che assumono le variabili dinamiche e cinematiche in gioco.
In altre parole tale teoria è una descrizione statistica delle proprietà dinamiche e cinematiche degli aggregati di particelle che costituiscono un sistema materiale.
La meccanica statistica è giunta per tale via ad ottenere risultati di grande rilievo, riuscendo a dimostrare che le variabili macroscopiche che descrivono lo stato esteriore della materia, come il volume, la pressione e la temperatura sono collegabili alle variabili microscopiche che descrivono il comportamento dinamico delle singole particelle, come l'energia cinetica media, la frequenza degli urti tra particelle etc.
Quella parte della meccanica statistica che descrive il moto disordinato delle particelle gassose viene comunemente indicata come teoria cinetica dei gas.
La teoria cinetica si applica ai gas perfetti e vale quindi solo se sono rispettate le seguenti condizioni:
1) Il volume delle particelle (covolume) è trascurabile rispetto al volume del gas.
2) Le forze intermolecolari sono trascurabili
3) il moto caotico delle particelle produce urti reciproci e con le pareti del recipiente perfettamente elastici.
Uno dei risultati più significativi della teoria cinetica dei gas è l'aver dimostrato che la Pressione di un gas dipende dall'energia cinetica media delle particelle che lo compongono![]() e dalla concentrazione del gas (numero di particelle per unità di volume).
e dalla concentrazione del gas (numero di particelle per unità di volume).
Per una mole di gas, composto da N molecole in un volume V, vale
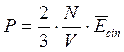
Relazione tra pressione , energia cinetica media e concentrazione delle particelle
Consideriamo per semplicità una mole di un gas, ossia N molecole, contenute in un cubo di lato l, sufficientemente grande da poter trascurare gli urti reciproci tra particelle (il gas deve cioè essere sufficientemente rarefatto).Le particelle sono perciò libere di rimbalzare attraverso urti perfettamente elastici avanti e indietro tra due pareti opposte del cubo. Si supponga infine, per semplicità che 1/3 delle particelle si muova parallelamente all'asse x, 1/3 parallelamente all'asse y ed 1/3 parallelamente all'asse z, con velocità media
Consideriamo ora una particella di massa m che rimbalza tra due pareti opposte con velocità Ad ogni rimbalzo la variazione della quantità di moto sarà dunque pari a Dalla dinamica sappiamo che l'impulso sulla parete (F.t) è pari alla variazione della quantità di moto Vogliamo ora calcolare la frequenza degli urti sulla parete, pari al numero di particelle che urta la parete nell'unità di tempo. Poiché tra un urto e l'altro la particella percorre uno spazio pari a 2l e lo spazio s percorso nel tempo di un secondo è pari a s = numero urti al secondo =
La quantità di moto che 1 molecola trasmette alla parete in un secondo è quindi pari alla frequenza degli urti per l'impulso di un singolo urto quantità di moto per particella al secondo = Poiché il numero di particelle che urtano una parete è N/3, la quantità di moto totale per secondo è Quantità di moto totale per secondo =
Ricordando che essa è pari all'impulso Ft e che in questo caso t è pari ad un secondo, la forza F che le particelle esercitano su di una parete è pari a
poiché la pressione P è pari al rapporto tra forza F e superficie l2, otteniamo con l3 pari al volume V del recipiente
La relazione permette di affermare che la Pressione è direttamente proporzionale al numero di particelle per unità di volume (N/l3) (concentrazione del gas) e all'energia cinetica media delle particelle.
Si è ottenuta una relazione tra variabili macroscopiche (Pressione) e variabili microscopiche (concentrazione delle particelle ed energia cinetica media). |
La relazione può essere scritta anche
![]()
Analoga all'equazione di stato dei gas per 1 mole
PV = RT
Eguagliando i due secondi membri si ottiene
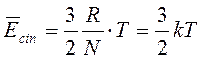
dove k è una nuova costante, detta costante di Boltzmann, pari al rapporto tra la costante dei gas R ed il numero di Avogadro N.
k = 1,3806 10-23 J/K (nel sistema SI)
k = 1,3806 10-16 erg/K (nel sistema cgs)
La relazione mette in evidenza il rapporto esistente tra un'altra variabile macroscopica, la Temperatura, ed una variabile microscopica, l'energia cinetica media delle particelle (![]() ).
).
La teoria cinetica dei gas dimostra per la prima volta che la temperatura di un corpo non è altro che l'espressione del moto disordinato delle sue particelle. Più precisamente possiamo affermare che la temperatura è una misura dell'energia cinetica media delle molecole che formano il gas
Attraverso la relazione precedente è ovviamente possibile calcolare la velocità quadratica media con cui si muovono delle molecole di massa nota, all'interno di un gas di temperatura T
![]() da cui
da cui 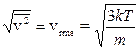
La velocità quadratica media vrms (rms = root mean square) corrisponde alla radice quadrata della media dei quadrati delle velocità delle particelle (in statistica è nota come media quadratica) ed è leggermente diversa dalla velocità media ![]() .
.
Tenendo presente che k = R/N e che la massa di una molecola si può calcolare facendo il rapporto tra il suo peso molare ed il numero di Avogadro (m = Pm/N), sostituendo opportunamente la relazione diventa
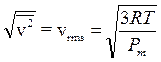
in cui utilizziamo i valori dei pesi molari, più comodi rispetto ai valori delle masse atomiche assolute (m) espresse in grammi.
L'equazione dimostra che ad una certa temperatura tutti i gas presentano la stessa energia cinetica media, ma velocità quadratica media diversa in funzione della loro massa.
Calcoliamo ad esempio la velocità quadratica media dell’Ossigeno molecolare O2 (Pm = 32 g/mol) a 20°C. Per ottenere il risultato in m/s è necessario usare tutte unità di misura del sistema internazionale. Dunque R = 8.31 Pa m3 K-1, mentre il peso molare andrà espresso in Kg/mol e dunque per l’Ossigeno sarà 32 10-3 kg/mol
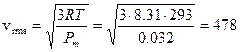 m/s
m/s
La velocità quadratica media può essere infine calcolata in funzione della pressione e della densità ρ (massa volumica) del gas.
Moltiplichiamo numeratore e denominatore sotto radice per il numero di moli n e per il volume V del recipiente, ottenendo
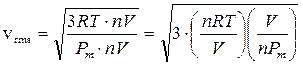
Si noti che la quantità (n·Pm)/V è il rapporto tra il peso di n moli ed il volume in cui sono contenute e rappresenta pertanto la densità ρ del gas (o massa volumica) espressa in kg/m3 (o, il che è lo stesso, in g/dm3 o g/L). La relazione diventa quindi
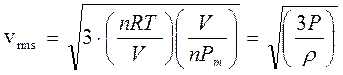
Calcoliamo ad esempio la velocità quadratica media di 3 moli di Ossigeno molecolare O2 (Pm = 32 g/mol) a 20°C contenute in un recipiente di 5L.
Anche in questo caso per ottenere il risultato in m/s è necessario usare tutte unità di misura del sistema internazionale. La pressione dell’ossigeno in pascal sarà
![]() Pa
Pa
3 moli di Ossigeno pesano 3 x 32 = 96 g = 0.096 kg e quindi la densità del gas è 0.096/0.005 = 19,2 kg/m3.
Sostituendo opportunamente si avrà in definitiva
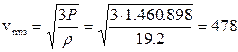 m/s
m/s
Secondo la teoria cinetica la velocità così calcolata rappresenta naturalmente solo un valore medio in quanto all'interno del gas le particelle possono assumere valori di velocità molto differenti dal valore medio.
Partendo dall'ipotesi che le particelle si scambino continuamente quantità di moto a causa dei loro urti reciproci e casuali, Maxwell dimostrò che all'interno del gas si stabilisce alla fine un equilibrio dinamico in cui è possibile calcolare la probabilità che una particella possieda una certa velocità, diversa dalla velocità media.
Maxwell ottenne così una relazione matematica, nota come funzione di distribuzione delle velocità F(v) o maxwelliana. In generale una funzione di distribuzione F(x) fornisce la frazione di oggetti che hanno la proprieta’ x. La maxwelliana fornisce dunque la frazione di molecole ![]() (da 0 ad 1) che possiedono una certa velocità v.
(da 0 ad 1) che possiedono una certa velocità v.
Naturalmente, essendo la frequenza una misura della probabilità (in questo caso una misura molto buona essendo le particelle molto numerose) , la relazione di Maxwell ci permette di calcolare anche la probabilità che una particella possieda una determinata velocità.
La forma di tale distribuzione dipende essenzialmente dalla massa (m) della particella e dalla temperatura assoluta T.
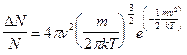
o, operando un cambio di variabile e ricordando che ![]()
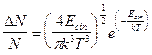
La quantità ![]() è detta fattore di Boltzmann ed è correlata alla probabilità che una particella presenti energia E.
è detta fattore di Boltzmann ed è correlata alla probabilità che una particella presenti energia E.
Tenendo presente che k = R/N ed m = Pm/N, facendo le opportune sostituzioni si ottiene
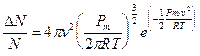
Da tale relazione è possibile ottenere, oltre alla velocità quadratica media, che coincide ovviamente con il valore che abbiamo già calcolato, anche la velocità media ![]()
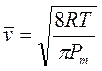
e la velocità più frequente (e quindi più probabile) che coincide con il massimo della curva (conosciuto in statistica come "moda")
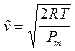
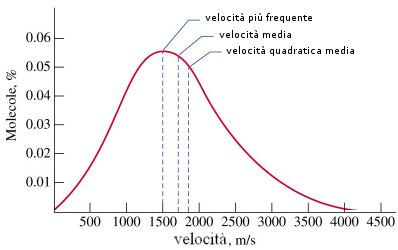
Le tre velocità presentano valori molto vicini che stanno nel seguente rapporto
![]() quadratica : media : moda = 1 : 0.9213 : 0.8165
quadratica : media : moda = 1 : 0.9213 : 0.8165
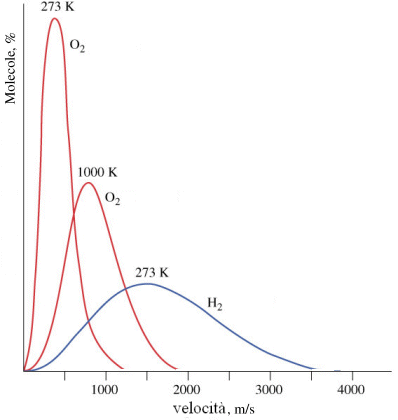
La forma e la posizione della curva rispetto agli assi dipende dai valori della temperatura e del peso molare del gas.
Possiamo ad esempio notare come la velocità più frequente (ma anche la velocità media e la velocità quadratica) sia proporzionale al rapporto T/PM.
All'aumentare del peso molare la curva si sposta verso sinistra (verso velocità minori).
Così alla temperatura di 20°C le molecole di idrogeno (Pm = 2) viaggiano ad una velocità media di 1760 m/s, le molecole di ossigeno (Pm = 32) a 440 m/s, mentre le molecole di anidride carbonica (Pm = 44) ad una velocità media di 375 m/s.
Le variazioni di temperatura producono un effetto opposto.
All'aumentare della temperatura la curva si sposta verso destra e le molecole possiedono quindi mediamente una velocità superiore.
Come si può notare i movimenti della curva in orizzontale si accompagnano a delle variazioni dell'ampiezza della curva stessa. Quando il massimo della curva si sposta verso sinistra (velocità medie basse) le particelle presentano valori di velocità meno dispersi, concentrandosi in un intervallo più ristretto. Viceversa quando il massimo della curva si sposta verso destra (velocità medie elevate) le particelle presentano valori di velocità più dispersi, distribuiti in un intervallo maggiore.
In altre parole all'aumentare della temperatura e al diminuire del peso molare aumenta la percentuale di molecole che presentano valori di velocità molto distanti dal valore medio.
In statistica il parametro che misura la dispersione dei valori intorno ai valori centrali (ampiezza della distribuzione di frequenza) è lo scarto quadratico medio (σ). Più elevato è il suo valore, più dispersi sono i valori intorno alla media.
Lo scarto quadratico medio è pari alla radice quadrata della differenza tra media quadratica e media aritmetica. Utilizzando la velocità quadratica media e la velocità media la relazione diventa
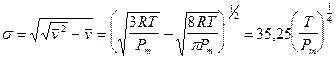
che ci conferma come la dispersione della curva aumenti all'aumentare della temperatura e al diminuire del peso molare.
Si noti infine che, poiché l'area sottesa alla curva (integrale della funzione) rappresenta il numero totale delle particelle (somma di tutte le frequenze), essa è costante ed il suo valore deve sempre essere pari ad 1.
Per questo motivo quando la dispersione aumenta la curva necessariamente si abbassa, in modo che l'area sottesa non vari.
Ciò significa che per temperature superiori e/o pesi molari inferiori diminuisce la percentuale di molecole che presentano valori di velocità vicini al valore medio.
La velocità con cui un gas fuoriesce da un foro di piccole dimensioni è inversamente proporzionale alla radice quadrata del suo peso molecolare.
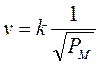
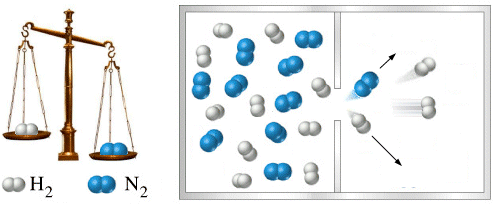
Essendo la velocità inversamente proporzionale al tempo impiegato dal gas per uscire, la legge di Graham può essere data, in forma equivalente, affermando che il tempo impiegato da un gas per diffondere attraverso un foro di piccole dimensioni è direttamente proporzionale alla radice quadrata del suo peso molecolare.
![]()
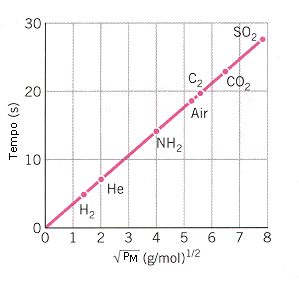
In tal modo, misurando il tempo impiegato da gas diversi per diffondere, è possibile, conoscendo il peso molecolare di uno dei due gas, calcolare il peso molecolare incognito del secondo gas
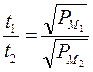
In passato tale tecnica è stata spesso usata per misurare il peso molecolare di composti volatili. Sapendo ad esempio che l’ossigeno impiega 4 volte più tempo dell’idrogeno ad uscire, se ne deduce che una molecola di Ossigeno pesa 16 volte più di una molecola di Idrogeno
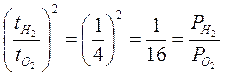
Oggi esistono gli spettrometri di massa, di gran lunga più precisi.
Un altro metodo per misurare il peso molare di un composto volatile sfrutta l'equazione di stato dei gas perfetti. Ricordando infatti che il numero di moli è pari al rapporto tra il peso in grammi (W) ed il peso molare (PM), possiamo scrivere
e quindi
Al secondo membro si trova la costante R di cui conosciamo il valore e 4 variabili facilmente misurabili |
La legge di Graham fu ottenuta sperimentalmente, ma essa è facilmente derivabile per via teorica dalla teoria cinetica dei gas.
La velocità media delle particelle che costituiscono un gas alla temperatura T è infatti pari
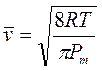
Quando due o più gas vengono mescolati in un recipiente, senza che tra essi avvenga alcuna reazione, la pressione totale esercitata dalla miscela gassosa è uguale alla somma delle pressioni che ciascun componente la miscela eserciterebbe se occupasse da solo tutto il recipiente (pressione parziale del componente).
![]()
La pressione parziale di un generico componente imo sarà pari a
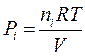
Ciascun componente gassoso si comporta dunque come fosse da solo e contribuisce alla pressione totale in proporzione al suo numero di moli.
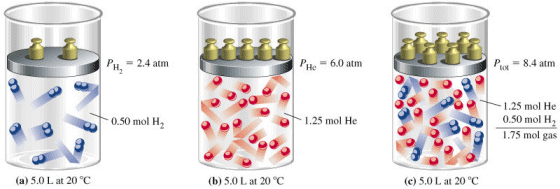
Se in un recipiente vi sono n1 moli del gas 1, n2 moli del gas 2,.....nn moli del gas n, l'effetto complessivo sarà equivalente alla presenza di n1+ n2 +......+ nn= n moli di un unico gas nel recipiente.
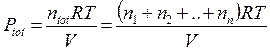
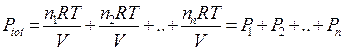
Dividendo membro a membro l'equazione di stato di ciascun componente per l'equazione di stato della miscela si ottiene
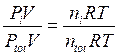
dalla quale si ricava la seguente relazione alternativa per la legge di Dalton, valida per un generico componente imo
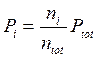
dove il rapporto ![]() è detto frazione molare del componente imo.
è detto frazione molare del componente imo.
La legge di Dalton si esprime quindi anche dicendo che "la pressione parziale di un componente gassoso è pari al prodotto tra la sua frazione molare e la pressione totale della miscela".
Si noti che la somma di tutte le frazioni molari deve sempre necessariamente essere pari all'unità.
Tutti i gas possono essere liquefatti per compressione e/o raffreddamento. Esiste tuttavia una temperatura, detta temperatura critica, al di sopra della quale il gas non liquefa, qualunque sia la pressione alla quale viene sottoposto (per l’acqua 374 °C).
Un aeriforme che si trovi al di sopra della temperatura critica è detto gas.
Un aeriforme che si trovi al di sotto della temperatura critica è detto vapore.
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve