I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Come abbiamo già avuto modo di dire il modello planetario di Rutherford risultava in contraddizione con i principi dell'elettrodinamica classica e doveva pertanto essere corretto. Rimaneva inoltre ancora irrisolto il problema degli spettri a righe, la cui soluzione appariva con molta probabilità legata proprio alla struttura atomica.
Visto il successo ottenuto nella risoluzione del problema del corpo nero e dell'effetto fotoelettrico, attraverso l'introduzione nel formalismo matematico della costante di Planck, Bohr decise di tentare la stessa strada anche per risolvere il problema degli spettri a righe.
Preso in considerazione l'atomo di Idrogeno, Bohr introdusse alcune ipotesi in modo da far intervenire all'interno della struttura atomica la costante h.
1a ipotesi |
Esiste uno stato stazionario dell'atomo caratterizzato da particolari orbite circolari lungo le quali gli elettroni si muovono senza emettere radiazioni elettromagnetiche. Gli elettroni che percorrono tali orbite stazionarie possiedono una certa quantità ben definita di energia detta livello energetico dell'orbita.
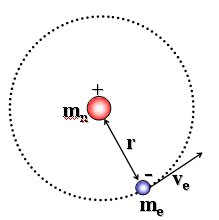
Essendo gli elettroni in equilibrio in tali orbite la forza centrifuga (![]() ) deve eguagliare la forza di attrazione coulombiana
) deve eguagliare la forza di attrazione coulombiana ![]() tra l'elettrone negativo ed il suo nucleo, contenente Z protoni con carica pari alla carica e dell’elettrone. Per l’Idrogeno Z = 1 e la relazione diventa
tra l'elettrone negativo ed il suo nucleo, contenente Z protoni con carica pari alla carica e dell’elettrone. Per l’Idrogeno Z = 1 e la relazione diventa
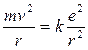
da cui si ricava il raggio
1) 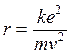
2a ipotesi |
A questo punto Bohr impose, del tutto arbitrariamente una condizione di quantizzazione. Tra le infinite orbite che soddisfano la 1) sono permesse solo quelle che soddisfano la seguente relazione
2) 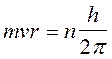
dove mvr è il momento della quantità di moto dell'elettrone in orbita attorno al suo nucleo, detto anche momento angolare orbitale. h/2p prende il nome di costante di Planck normalizzata e viene spesso indicata con ![]() (acca tagliato) ed n è un numero intero positivo, detto numero quantico principale. In pratica Bohr impone una condizione di quantizzazione del momento angolare, che si rivelerà in seguito fondamentale e caratteristica di qualsiasi corpo rotante.
(acca tagliato) ed n è un numero intero positivo, detto numero quantico principale. In pratica Bohr impone una condizione di quantizzazione del momento angolare, che si rivelerà in seguito fondamentale e caratteristica di qualsiasi corpo rotante.
Tale condizione si esprime dicendo che il momento angolare dell'elettrone deve essere un multiplo intero di acca tagliato.
Il momento angolare quantizzato condiziona i valori che possono assumere il raggio delle orbite e l’energia totale (cinetica + potenziale) o livello energetico, che l’elettrone possiede.
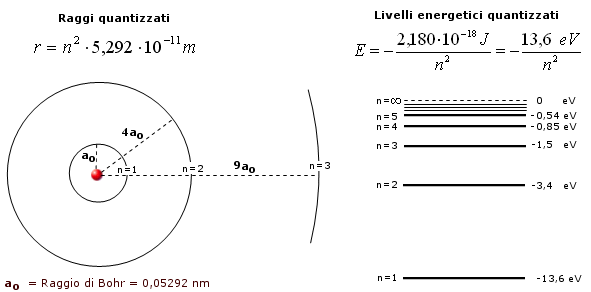
Raggi e livelli energetici risultano pertanto anch’essi quantizzati in funzione di n.
Raggio quantizzato: Dalla condizione di quantizzazione del momento angolare si ricava la velocità che sostituita nella 1) fornisce la relazione quantistica del raggio
![]()
per n = 1
r = 5,292 10-11 m (= 52,92 pm = 0,5292 Å) è il raggio della orbita circolare più vicina al nucleo dell’Idrogeno ed è detto raggio di Bohr (ao) .
In fisica atomica il raggio di Bohr ao viene utilizzato come unità di misura di lunghezza e denominato bohr.
1 bohr = 5,291772 10-11 m
Energia quantizzata (livello energetico): L’energia associata ad un elettrone in moto su di un’orbita quantizzata si calcola come somma dell’energia cinetica (![]() ) e dell’energia potenziale (
) e dell’energia potenziale (![]() ). Se esplicitiamo dalla 1) la quantità
). Se esplicitiamo dalla 1) la quantità ![]() e la sostituiamo nell’espressione dell’energia cinetica, l’energia totale vale
e la sostituiamo nell’espressione dell’energia cinetica, l’energia totale vale
![]()
Sostituendo r con il valore quantizzato del raggio si ottiene
![]()
pari a –13,61 n-2 eV.
Il valore negativo dell'energia deriva dalla convenzione di porre pari a zero l'energia potenziale dell'elettrone a distanza infinita.
Per n = 1 l’elettrone si trova nello stato di minima energia possibile, detto stato fondamentale. Gli stati caratterizzati da n > 1 si dicono stati eccitati.
In fisica atomica l’energia potenziale coulombiana dell’elettrone nella prima orbita di Bohr viene utilizzata come unità di misura di energia e denominata hartree (in onore del fisico inglese Douglas Rayner Hartree).
.
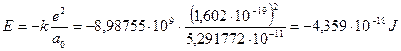
1 hartree = 4,359 10-18 J
Un hartree corrisponde al doppio dell'energia di legame dell'elettrone nello stato fondamentale (n = 1) dell'atomo di idrogeno
3^ Ipotesi |
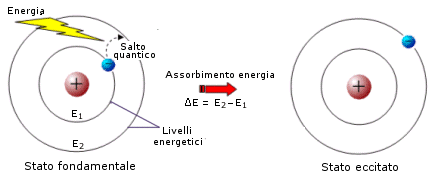
L'atomo può passare dallo stato fondamentale ad uno eccitato assorbendo energia. In questo modo gli elettroni possono assumere l'energia necessaria per passare da un'orbita più interna ad una più esterna. L'energia assorbita affinché avvenga il salto quantico dell'elettrone, o transizione elettronica, deve essere esattamente uguale alla differenza di energia esistente tra il livello energetico superiore e quello inferiore.
![]()
Quando l'elettrone si trova in un orbita superiore a quella in cui si trova normalmente, l'atomo possiede un surplus di energia che lo rende instabile (eccitato). L'elettrone è quindi destinato a tornare nell'orbita di partenza riemettendo l'energia precedentemente assorbita tramite un fotone la cui energia è appunto pari a
E2 – E1 = DE = hn
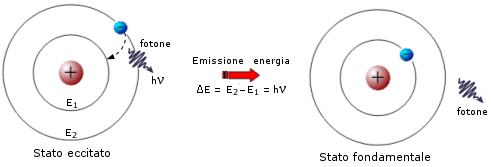
La radiazione emessa, avendo una frequenza univocamente determinata dalla differenza di energia esistente tra due particolari livelli energetici, è rigorosamente monocromatica ed apparirà come una ben determinata riga allo spettroscopio.
L’energia emessa durante una transizione da un livello n2 ad un livello n1, con n2 > n1, è
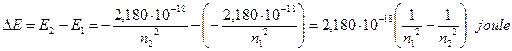
Ricordando che DE = hn e che c = ln, sostituendo opportunamente si ottiene ![]() , quindi
, quindi ![]() ed in definitiva
ed in definitiva

Per calcolare il numero d’onde![]() (reciproco della lunghezza d’onda) della riga emessa durante una transizione elettronica, Bohr ritrova dunque, per via teorica, la medesima relazione trovata empiricamente da Balmer :
(reciproco della lunghezza d’onda) della riga emessa durante una transizione elettronica, Bohr ritrova dunque, per via teorica, la medesima relazione trovata empiricamente da Balmer : ![]()
I numeri interi n ed m che nella relazione di Balmer non presentavano alcun significato fisico, nel modello atomico di Bohr diventano rispettivamente il numero quantico del livello più interno n1 ed il numero quantico del livello più esterno n2, tra i quali avviene la transizione.
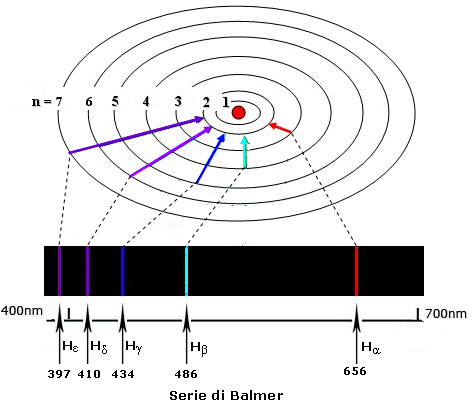
Il numero quantico principale n può assumere teoricamente tutti i valori compresi tra 1 ed infinito. In pratica però tutti gli atomi conosciuti sistemano i loro elettroni al massimo in 7 livelli energetici, i quali vengono spesso indicati con le lettere K, L, M, N, O, P, Q.
Righe spettrali (λ in nm) |
||||||||||
|
|
n esterno |
||||||||
Serie |
n interno |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
∞ |
Lyman |
1 |
121,6 |
102,5 |
97,2 |
94,9 |
93,7 |
93,0 |
92,6 |
92,3 |
91,15 |
Balmer |
2 |
|
656.3 |
486.1 |
434.1 |
410.2 |
397.0 |
388.9 |
383.5 |
364.6 |
Paschen |
3 |
|
|
1874.5 |
1281.4 |
1093.5 |
1004.6 |
954.3 |
922.6 |
820.1 |
Brackett |
4 |
|
|
|
4052.5 |
2625.9 |
2166.1 |
1945.1 |
1818.1 |
1458.0 |
Pfund |
5 |
|
|
|
|
7476 |
4664 |
3749 |
3304 |
2279 |
Un altro aspetto notevole del modello di Bohr è che la costante di Rydberg viene ad essere calcolata in funzione di costanti note (come la carica dell’elettrone, la sua massa, la velocità della luce, etc) ed il suo valore risulta in ottimo accordo con il valore misurato sperimentalmente
Costante di Rydberg Condizione di equilibrio dinamico: forza centrifuga = forza coulombiana 1) Condizione di quantizzazione del momento angolare orbitale 2) Dalla 2) esplicitiamo la velocità 3) L’energia totale di un livello (cinetica + potenziale) è 4) Dalla 1) esplicitiamo 5) Sostituiamo nella 5) il raggio r con il valore quantizzato della 3) per avere l’energia quantizzata 6) La differenza di energia tra un livello energetico n2 esterno ed un livello n1 più interno è 7) Poiché 8) Come si può facilmente verificare, tale relazione corrisponde a quella trovata sperimentalmente da Balmer ed il termine
che descriva un'orbita di raggio r = rm + rM attorno al baricentro. In altre parole la 1) rimane valida se si sostituisce la massa dell’elettrone con la sua massa ridotta. Così la costante di Rydberg R, corretta per un elemento di massa M, è
dove
Tenendo conto che per l'idrogeno m/M è pari a 1/1836, la costante di Rydberg corretta per l’Idrogeno vale
Valore che coincide perfettamente con il dato sperimentale. Per lo stesso motivo è da prevedersi uno spostamento delle righe spettrali quando invece dell'idrogeno comune si consideri un suo isotopo pesante. Il Deuterio, ad esempio, che possiede un nucleo doppiamente pesante, essendo composto di un protone e di un neutrone, dovrebbe presentare uno spostamento delle righe spettrali di notevole entità e quindi facilmente osservabile (il rapporto m/M diventa infatti 1/3672). Il Deuterio fu scoperto nel 1932 da H.C. Ureyproprio osservando il previsto spostamento delle righe spettrali.
|
Calcoliamo a titolo d’esempio il dislivello energetico esistente tra n = 2 ed n = 3, la frequenza e la lunghezza d'onda della riga spettrale (Ha) della transizione elettronica relativa.
![]()
![]()
![]()
Il modello di Bohr è in grado di giustificare in modo soddisfacente solo il comportamento spettrale dell’Idrogeno e degli atomi idrogenoidi (ioni di altri elementi leggeri con un solo elettrone, come He+ e Li2+), mentre risulta inadeguato per atomi plurielettronici. D'altra parte quando Bohr impose la sua condizione di quantizzazione non poté darne alcuna giustificazione teorica, se non quella che in tal modo era possibile calcolare il valore numerico della costante di Rydberg e le righe spettrali dell’Idrogeno. Solo una decina di anni più tardi Louis De Broglie, avrebbe dimostrato che la condizione imposta da Bohr era una conseguenza della natura ondulatoria dell'elettrone.
Tra il 1913 ed il 1914 venne un'ulteriore conferma del modello atomico di Bohr, grazie agli esperimenti condotti da Moseleysugli spettri di emissione a righe nella regione della radiazione X di vari elementi chimici.
Quando un elettrone del primo livello energetico (livello K) viene espulso, in seguito ad una collisione con un elettrone proiettile o in seguito ad irradiazione con fotoni altamente energetici (gli elettroni del primo livello sono fortemente legati), il suo posto può essere occupato da un elettrone presente nei livelli superiori. Se l'elettrone proviene dal livello L (n = 2) la riga spettrale che si forma è detta K, se proviene dal livello M (n = 3) è detta K, e così via.
Se l'elettrone inizialmente espulso interessa il livello L, le righe che si formano per transizione elettronica dagli strati superiori M, N... sono dette L, L...
La serie K è sostanzialmente analoga alla serie di Lyman per l'idrogeno, ma si manifesta nella regione X.
Le diverse righe della serie K presentano naturalmente un valore diverso nei vari elementi chimici, a causa delle differenze di energia esistenti tra livelli energetici dello stesso tipo in atomi aventi una diversa carica nucleare Z.
Moseley dimostrò che la riga più intensa di questi spettri (riga K) si spostava regolarmente quando si passava da un elemento al successivo nella tavola periodica e che la lunghezza d'onda di tale riga si poteva esprimere in funzione del numero atomico Z, attraverso una relazione sostanzialmente analoga alla relazione di Balmer
![]()
Utilizzando il sistema di unità di misura cgs, la costante di proporzionalità k vale ![]()
e la carica dell'elettrone, espressa in u.e.s., vale e = 4,80296.10-10 u.e.s.
Nel Sistema Internazionale k = 8,98755179 109 (N m2 C-2).
ao = 5,2917720859 10-11 m
2,1798719 10-18 J
Quando si fa riferimento all’energia associata ad una sola particella è più comodo utilizzare l’elettronvolt (eV). 1 eV è l’energia cinetica acquistata da un elettrone sottoposto alla differenza di potenziale di 1 Volt. 1 eV = 1, 6022 10-19 C x 1 V = 1,6022 10-19 joule
dove a è la costante di schermo, introdotta per tener conto del fatto che la carica del nucleo "vista" da ciascun elettrone è, a causa della presenza degli altri elettroni, inferiore a Ze.
Per la riga K la relazione diventa
![]()
La relazione dimostra che la radice quadrata della lunghezza d'onda è inversamente proporzionale al numero atomico Z.
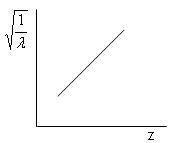
Spostamento delle righe K
in funzione del numero atomico Z
Ciò, oltre a confermare il modello di Bohr, permise, da una parte di dare al numero atomico Z il suo significato preciso di numero di cariche elettriche concentrate nel nucleo (e quindi anche di numero di elettroni orbitanti esternamente per rendere l'atomo neutro), dall'altra di ordinare correttamente gli elementi nella tavola periodica secondo il numero atomico crescente e non secondo il peso atomico crescente. Gli elementi devono infatti essere ordinati con lo stesso ordine con cui si succedono le righe della serie K. Risultò ad esempio che il Co precede il Ni e non viceversa .
Del 1914 sono gli esperimenti condotti da J. Francke G. Hertz (nipote di H. Hertz) i quali scoprirono che gli elettroni, quando attraversano i vapori di Mercurio, subiscono una perdita di energia secondo “livelli” discreti e che a tale perdita di energia corrisponde una emissione di radiazioni ultraviolette (l = 254 nm) da parte del Mercurio. Pochi mesi più tardi Niels Bohr si rese conto che si trattava di una chiara conferma della validità del suo modello atomico quantizzato.
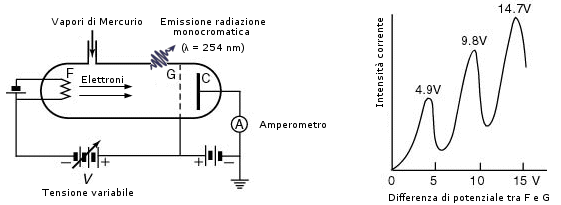
Esperimento di Franck-Hertz
Tra il filamento emittente F e la griglia G viene applicata una differenza di potenziale variabile. Tra la griglia G ed il collettore C viene applicata una differenza di potenziale costante di segno opposto di -1,5 V che esercita un’azione frenante, in modo che solo gli elettroni che hanno acquistato una sufficiente energia cinetica sono in grado di raggiungere il collettore C e contribuire alla circolazione di corrente. Finchè la differenza di potenziale è inferiore a 4,9 V gli elettroni urtano gli atomi di Mercurio in modo elastico, senza cedere energia e, attraversata la griglia, possiedono sufficiente energia per raggiungere il collettore e generare una corrente elettrica. la cui intensità viene misurata (amperometro). In corrispondenza di una tensione di 4,9 V gli elettroni hanno sufficiente energia per eccitare gli atomi di Mercurio che emettono una riga spettrale nell’ultravioletto a 254 nm. La cessione di energia agli atomi di Mercurio, rallenta gli elettroni, facendo diminuire l’intensità di corrente al collettore. Aumentando ulteriormente la tensione il fenomeno si ripresenta con regolarità per valori di tensione multipli di 4,9 V. Infatti, in corrispondenza di una tensione doppia (9,8 V) un elettrone ha sufficiente energia per eccitare in successione due atomi di mercurio, mentre con una tensione tripla (14,7 V) può eccitarne tre e così via.
Nel 1921 Otto Sterne W. Gerlach verificarono un'altra conseguenza della teoria di Bohr. Infatti non solo le singole orbite, ma anche l'intero atomo deve possedere un momento angolare quantizzato, calcolato come vettore risultante dei singoli momenti interni.
In pratica quindi anche l'intero atomo (se possiede un momento magnetico risultante netto) può assumere solo orientazioni spaziali discrete.
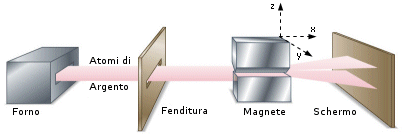
Esperimento di Stern-Gerlach
Un fascio di atomi di Argento attraversa un campo magnetico fortemente disomogeneo. I poli del magnete sono stati sagomati in modo che sul fascio di atomi agisca una forza deviante costante solo in direzione z e nulla in x ed y. Gli atomi si dividono in due fasci, colpendo lo schermo in due punti disposti simmetricamente rispetto alla direzione originaria. Gli atomi dimostrano pertanto di possedere un momento magnetico netto che si orienta in due soli modi possibili e controversi (spin antiparalleli) rispetto al campo magnetico applicato.
Tra le ipotesi iniziali di Bohr vi era quella che le orbite degli elettroni fossero circolari. Si trattava di un'ipotesi semplificatrice visto che la teoria di Bohr si basa sulla legge di Coulomb, formalmente simile alla legge di gravitazione universale, la quale costringe i corpi a ruotare intorno ad un baricentro comune su orbite ellittiche (la circonferenza può essere considerata un caso particolare di ellisse, con e = 0).
Nel 1915 A. Sommerfeld portò delle modificazioni al modello iniziale di Bohr, introducendo appunto delle orbite ellittiche in cui il nucleo occupava uno dei due fuochi, in modo del tutto analogo a quanto accade per le orbite planetarie.
Egli dimostrò che mentre nel primo livello l'elettrone poteva percorrere solo un'orbita circolare. nel secondo livello oltre ad un'orbita circolare l'elettrone avrebbe potuto occupare con la stessa energia, anche un'orbita ellittica avente l'asse maggiore della stessa lunghezza del diametro dell'orbita circolare.
Nel terzo livello era poi possibile per l'elettrone occupare, oltre all'orbita circolare due orbite ellittiche aventi assi maggiori uguali al diametro dell'orbita circolare, ma diversa eccentricità e cosi via.
L'introduzione delle orbite ellittiche sembrò rappresentare inizialmente una inutile complicazione nei calcoli. Esse permisero invece di risolvere il problema della cosiddetta struttura fine delle righe spettrali.
Con l'affinamento delle tecniche spettroscopiche risultò infatti che, utilizzando maggiori risoluzioni, ciascuna riga spettrale appariva composta da una serie di sottili righe molto ravvicinate, ad indicare la probabile esistenza di sottolivelli all'interno di ciascun livello energetico principale.
La teoria di Bohr era una teoria non relativistica, nel senso che non utilizzava nel suo formalismo le relazioni della relatività speciale. In effetti le equazioni della relatività speciale possono essere trascurate senza incorrere in errori eccessivi se i corpi che si stanno studiando presentano velocità molto inferiori alla velocità della luce. Nel caso la velocità del corpo oggetto di studio si avvicini a quella della luce, la relatività dimostra che la massa del corpo non rimane costante ma cresce al crescere della velocità in modo sensibile.
Tenendo presente che gli elettroni viaggiano a velocità molto elevate intorno al nucleo atomico, Sommerfeld introdusse le condizioni relativistiche nel modello di Bohr.
In pratica, ricordando che nel moto lungo un'ellisse l'elettrone è costretto a viaggiare più velocemente quando si trova più vicino al nucleo e più lentamente quando si trova più distante, la massa elettronica subisce delle modificazioni, aumentando in prossimità del nucleo e diminuendo nel punto più distante. Ciò comporta una diversificazione, seppur minima, delle energie associate alle orbite ellittiche, le quali non coincidono più con le energie delle orbite circolari del livello di appartenenza.
L'introduzione delle condizioni relativistiche da parte di Sommerfeld permise di spiegare in parte la struttura fine dello spettro.
Le orbite ellittiche di Sommerfeld resero però necessaria l'introduzione di un altro numero quantico detto numero quantico secondario o azimutale indicato con l.
l è un numero intero positivo il cui valore dipende dal valore assunto da n
0 £ l £ n - 1
Quindi
se n = 1 l = 0 ® orbita di tipo s
( ciò significa che nel primo livello vi è una sola orbita circolare, indicata appunto con l = 0, o anche con la lettera 's').
se n = 2 l = 0 ® orbita di tipo s
l = 1 ® orbita di tipo p
(ciò significa che nel secondo livello oltre ad una orbita circolare (l = 0), naturalmente di diametro maggiore della precedente, vi è anche un'orbita ellittica ( l = 1) indicata anche con la lettera 'p'.
se n = 3 l = 0 ® orbita di tipo s
l = 1 ® orbita di tipo p
l = 2 ® orbita di tipo d
(ciò significa che nel terzo livello possono trovar posto oltre ad un'orbita circolare s ed una ellittica di tipo p, una seconda orbita ellittica (l = 2), avente naturalmente eccentricità differente, indicata anche con la lettera 'd'.
se n = 4 l = 0 ® orbita di tipo s
l = 1 ® orbita di tipo p
l = 2 ® orbita di tipo d
l = 3 ® orbita di tipo f
(ciò significa che nel quarto livello, oltre alle precedenti orbite può trovar posto una terza orbita ellittica (l = 3), avente forma diversa ed indicata con la lettera 'f'.
In pratica il numero quantico secondario determina la forma dell'orbita descritta dall'elettrone. Comunemente però i quattro tipi di orbite possibili vengono per semplicità indicate con le lettere s, p, d ed f.
Le lettere s, p, d, f sono le iniziali dei termini con cui storicamente venivano indicate in spettroscopia le righe corrispondenti; sharp, principal, diffuse e fundamental.
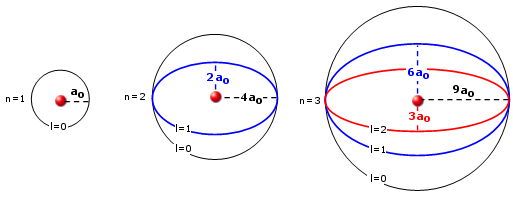
Orbite ellittiche di Sommerfeld per i primi tre livelli energetici (ao = raggio di Bohr)
Il numero dei sottolivelli prodotto dall'introduzione delle orbite ellittiche non era comunque ancora sufficiente a giustificare tutta la ricchezza della struttura fine dello spettro.
Fin dal 1896 era noto che quando una sorgente luminosa viene sottoposta ad un campo magnetico, le righe spettrali vengono ulteriormente scomposte in diverse componenti (effetto Zeeman)
Il fenomeno può essere spiegato osservando che un'orbita elettronica si comporta come una spira percorsa da corrente elettrica e, come previsto da Ampere nel 1820, produce un momento magnetico che dipende dal suo momento angolare.
Poiché il momento angolare è quantizzato anche il momento magnetico lo è.
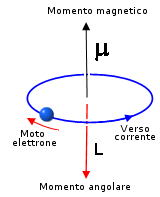
Si dimostra che il momento magnetico è sempre multiplo di una quantità minima detta magnetone di Bohr (mb)
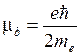
Ora è possibile dimostrare che una stessa orbita sottoposta ad un campo magnetico esterno può orientare il suo vettore momento magnetico solo in alcune direzioni, diversificando il suo contenuto energetico e dando perciò luogo ad ulteriori sottolivelli. Il numero delle direzioni consentite viene espresso dal cosiddetto numero quantico magnetico m che può assumere solo i valori interi compresi tra -l e + l.
-l £ m £ +l
In effetti tali sottolivelli vengono solamente resi più evidenti dall'effetto Zeeman. Essi esistono normalmente nell'atomo poiché le orbite elettroniche sono sottoposte al campo magnetico prodotto dal nucleo carico positivamente.
se l = 0 (orbita circolare s) m = 0
ciò significa che sottoposta ad un campo magnetico esterno un'orbita circolare dà luogo ad un’unica orientazione. Avremo perciò una sola orbita circolare di tipo s.
se l = 1 (orbita ellittica di tipo p) m può assumere i valori +1 0 -1
ciò significa che tale orbita può orientarsi in tre modi diversi producendo tre sottolivelli a differente energia. Avremo perciò 3 orbite di tipo p, indicate ciascuna con un diverso valore di m.
se l = 2 (orbita ellittica di tipo d) m può assumere i valori +2 +1 0 -1 -2
ciò significa che questo tipo di orbita ellittica può orientarsi in 5 modi differenti producendo quindi 5 sottolivelli a differente energia. Avremo perciò 5 orbite di tipo d, indicate ciascuna con un diverso valore di m.
se l = 3 (orbita ellittica di tipo f) m può assumere i valori +3 +2 +1 0 -1 -2 -3 ( ciò significa che questo tipo di orbita può orientarsi in 7 modi diversi, producendo 7 sottolivelli a differente energia. Avremo perciò 7 orbite di tipo f, indicate ciascuna con un diverso valore di m.
In pratica il valore del numero quantico magnetico determina il numero di orbite di una certa forma presenti in ciascun livello energetico principale.
Il modello di Bohr-Sommerfeld rimane sostanzialmente invariato anche per atomi con maggior numero di protoni nel nucleo e quindi di elettroni in orbita intorno ad esso. L'unica differenza è in pratica dovuta al fatto che la maggior attrazione esercitata dal nucleo fa diminuire il diametro di tutte le orbite permesse. Il fatto permette di spiegare in modo naturale la diversità degli spettri dei vari elementi, in quanto essendo le orbite via via più compresse anche i salti quantici tra un'orbita e l'altra risultano di differente entità, producendo quindi righe spettrali peculiari.
Vi era tuttavia un problema in quanto per la fisica classica un sistema meccanico è stabile quando possiede il minor contenuto energetico. Pertanto tutti gli elettroni che vengono introdotti nelle orbite dopo il primo, dovrebbero naturalmente liberarsi della loro energia addizionale attraverso una serie di transizioni verso il primi livello energetico. Gli elettroni degli atomi pesanti dovrebbero perciò in definitiva trovarsi addensati tutti sulla prima orbita.
Poiché però tale orbita diventa sempre più piccola per l'attrazione esercitata dai nuclei via via più carichi positivamente, gli elementi più pesanti dovrebbero presentare atomi con diametro via via minore, mentre l'esperienza dimostra che ciò non è vero.
Nel 1925 il fisico tedesco Wolfgang Pauli formulò il principio noto come principio di esclusione, che permise di descrivere correttamente la distribuzione degli elettroni nelle diverse orbite.
Il principio di esclusione di Pauli afferma che ogni orbita quantica non può contenere più di due elettroni, i quali si differenziano per il valore di un quarto numero quantico detto numero quantico di spin. Il numero di spin può assumere solo i valori +1/2 e -1/2.
Con una formulazione alternativa, ma equivalente diremo
Il principio di esclusione di Pauli afferma che in un atomo non possono esistere 2 elettroni con tutti e quattro i numeri quantici uguali.
In altre parole ogni combinazione particolare dei quattro numeri quantici individua uno ed uno solo elettrone.
Ciò ha una conseguenza importante sulle configurazioni elettroniche, in quanto se entrambi i posti disponibili in un orbita sono occupati, gli elettroni successivi devono prendere posto necessariamente in orbite più esterne, sempre due per orbita.
Nel novembre del 1925 G.E. Uhlenbeck e S.A. Goudsmit diedero significato fisico al numero quantico di spin, ipotizzando l'esistenza di un momento magnetico intrinseco dell'elettrone.
In altre parole è possibile immaginare l'elettrone carico negativamente come una piccola trottola che gira intorno al suo asse, in modo da produrre il momento magnetico osservato.
L’elettrone possiede un momento magnetico pari ad un magnetone di Bohr e, come conseguenza del suo moto di rotazione, anche un momento angolare intrinseco o spin, il cui valore può essere determinato in funzione del momento magnetico. Lo spin risulta essere pari a ![]() ed il suo verso è opposto al momento magnetico (a causa della carica negativa dell’elettrone)
ed il suo verso è opposto al momento magnetico (a causa della carica negativa dell’elettrone)
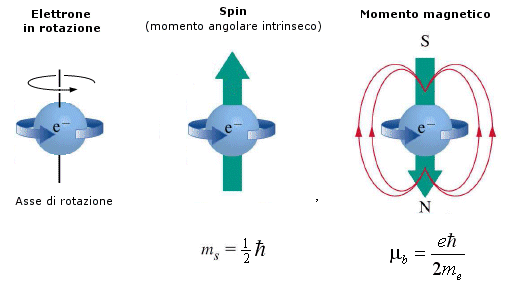
Il momento magnetico dell'elettrone, e quindi anche il suo momento angolare o spin, risulta quantizzato. Sottoposto ad un campo magnetico esterno lo spin dell’elettrone può infatti orientarsi nello stesso verso del campo o in verso opposto.
Convenzionalmente il vettore spin si considera parallelo alla direzione di avanzamento dell’elettrone, per cui i due elettroni si presenteranno:
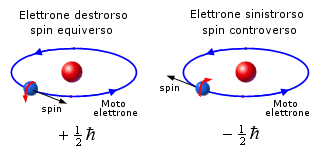
Dunque, in accordo con il principio di Pauli, in ogni orbita possono coesistere al massimo due elettroni i quali si distinguono per avere i vettori spin ad essi associati controversi o, come si usa impropriamente dire, antiparalleli.
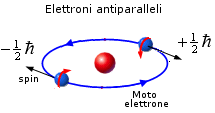
La scoperta dello spin dell'elettrone consentì di spiegare i risultati dell'esperimento di Stern-Gerlach. Gli atomi di argento possiedono infatti un numero dispari di elettroni ( Z = 47 ). Gli spin dei primi 46 elettroni si annullano a coppie, mentre lo spin dell'ultimo elettrone rimane come momento magnetico netto dell'intero atomo. In tal modo gli atomi che possiedono spin +1/2 vengono deflessi in una direzione, quelli che possiedono spin -1/2 in direzione opposta.
Nel 1926 Fermi fece una delle più feconde applicazioni del principio di esclusione, incorporandolo nella meccanica statistica ed ottenendo una nuova statistica, alternativa a quella già proposta da Bose e Einstein.
La formulazione del principio di esclusione e della statistica di Fermi che da esso deriva su basi rigorosamente quantistiche fu fatta da Dirac intorno al 1928. Tale statistica prende oggi il nome di statistica di Fermi-Dirac.
Solo nel 1940 Pauli scoprì un semplice criterio per determinare quali particelle obbediscono alla statistica di Bose-Einstein e quali alla statistica di Fermi-Dirac.
Il principio spiega in modo semplice anche la periodicità degli elementi chimici. Quando infatti un livello energetico risulta pieno di elettroni, i successivi sono costretti a riempire il livello energetico successivo, dove si trovano orbite dello stesso tipo del precedente, anche se di dimensioni maggiori. Gli elettroni si distribuiscono nei vari livelli con andamento regolare e periodico.
Poiché poi sono gli elettroni più esterni a fornire le caratteristiche chimiche all'elemento diventa ovvia anche la periodicità di tali caratteristiche che si riscontra nella tavola periodica.
Nella tavola periodica esistono quattro coppie di elementi (Ar/K, Co/Ni, Te/I, Th/Pa (Torio/Proattinio)) il cui ordine risulterebbe invertito se fossero ordinati secondo il peso atomico crescente. È notevole il fatto che Mendeleev decise di scambiarli di posto, pensando che il loro peso atomico fosse errato, classificandoli non in base al peso, ma alle loro caratteristiche chimiche
Spesso il magnetone di Bohr viene misurato utilizzando il sistema cgs elettromagnetico. In tal caso, per convertire la carica dell'elettrone, espressa in unità elettrostatiche (1 ues = statC = 1franklin), nelle corrispondenti unità elettromagnetiche (abCoulomb), è necessario dividerla per c, velocità della luce (1 abC = 10 C = c statC, con c = 3 1010 cm/s)) . La relazione diventa ![]() . Il magnetone di Bohr vale nel sistema SI 9,2740155.10-24 J T-1, nel sistema cgsem 9,2740155.10-21 erg G-1 e nel sistema cgses 2,7802799.10-10 erg statT-1.
. Il magnetone di Bohr vale nel sistema SI 9,2740155.10-24 J T-1, nel sistema cgsem 9,2740155.10-21 erg G-1 e nel sistema cgses 2,7802799.10-10 erg statT-1.
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve