I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Convenzionalmente ogni orbitale viene rappresentato mediante un quadrato all'interno del quale è possibile disporre fino ad un massimo di due elettroni rappresentabili mediante frecce verticali con verso opposto, ad indicare lo spin antiparallelo.
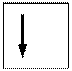
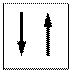
vuoto semisaturo saturo
(elettrone spaiato)
Ciascun orbitale viene poi indicato con una sigla composta da un numero da 1 a 7 che indica il livello energetico seguito da una lettera (s, p, d, f) che indica il tipo di orbitale. Ad esempio 1s rappresenta l'unico orbitale s del primo livello energetico; 2p indica i tre orbitali p del secondo livello energetico; 6d i cinque orbitali d del sesto livello energetico.
Dato un elemento di numero atomico Z, è possibile distribuire correttamente i suoi Z elettroni nei diversi orbitali seguendo le seguenti tre regole di riempimento (Regole di Aufbau):
Gli elettroni si dispongono spontaneamente negli orbitali vuoti meno energetici. Una volta riempiti gli orbitali a minor energia vengono occupati gradualmente gli orbitali ad energia progressivamente maggiore. L'ordine di riempimento ottenuto in tal modo non rispetta però sempre l'ordine di riempimento che ci si attenderebbe in base alla sequenza ordinata dei livelli energetici.
Il contenuto energetico degli orbitali è riportato nello schema seguente, in cui ogni orbitale è rappresentato come un quadrato.
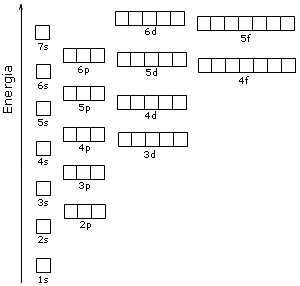
Come conseguenza di tale struttura energetica l’ordine di riempimento degli orbitali in funzione del loro contenuto energetico risulta essere quello che si ottiene seguendo le diagonali dello schema seguente.

E dunque
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d
Ogni orbitale può contenere al massimo 2 elettroni i quali saturano l’orbitale disponendosi con spin controversi (antiparalleli). Lo spin (momento angolare intrinseco) è una caratteristica vettoriale degli elettroni (gli elettroni si comportano come minuscole trottole che ruotano attorno al proprio asse e quindi possiedono un momento angolare). Un elettrone può possedere solo due valori di spin (anche lo spin è quantizzato). Gli elettroni negli orbitali vengono rappresentati con delle frecce verticali (che rappresentano il vettore spin).
Rappresentando dunque gli orbitali come quadrati o, come spesso si usa, come linee orizzontali, si possono presentare 3 situazioni
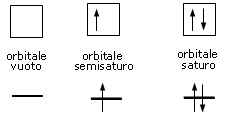
Un orbitale saturo presenta i due elettroni con spin antiparalleli (↑↓)
Gli elettroni si dispongono negli orbitali degeneri uno per orbitale con spin parallelo fino a semisaturarli tutti e, successivamente, li saturano seguendo il principio di esclusione Pauli. Così, se dobbiamo inserire 3 elettroni nei tre orbitali degeneri 2p, otterremo la seguente configurazione
![]() e non
e non ![]()
Esatto Errato!!
O, dovendo inserire 7 elettroni nei cinque orbitali degeneri 4d, si otterrà
![]() e non
e non ![]()
Esatto Errato!!
Applicando dunque le 3 regole di Aufbau possiamo ottenere la configurazione elettronica dell’Ossigeno (Z = 8). I suoi 8 elettroni si distribuiranno secondo il seguente schema
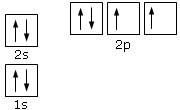
La configurazione elettronica dell’Ossigeno può essere riassunta in modo sintetico scrivendo gli elettroni ad esponente degli orbitali che li contengono
1s2 2s2 2p4
in cui i numeri ad esponente indicano quanti elettroni sono sistemati in quei particolari orbitali.
Se prendiamo in considerazione i diversi elementi a partire dall'idrogeno in ordine di numero atomico crescente possiamo osservare come al crescere di un'unità nel valore del numero atomico venga aggiunto un elettrone alla configurazione elettronica.
Ogniqualvolta una serie di elementi ha sistemato abbastanza elettroni da riempire un livello energetico, gli elementi successivi, che iniziano a riempire il successivo livello energetico, vengono disposti in una riga sottostante, detta periodo, in modo tale che risultino incolonnati con gli elementi che presentano la stessa configurazione elettronica superficiale.
In questo modo si vengono a formare 7 periodi, corrispondenti ai 7 livelli energetici riempibili e quindi al valore del numero quantico principale.
Gli elementi che si incolonnano verticalmente formano i cosiddetti gruppi, composti da elementi che presentano un egual numero di elettroni disposti sullo stesso tipo di orbitali, ma naturalmente su di un diverso livello energetico.
Poiché il comportamento chimico di un elemento dipende essenzialmente proprio dalla sua configurazione elettronica superficiale, elementi appartenenti ad uno stesso gruppo presentano forti analogie e somiglianze chimiche (stesso tipo di reazioni).
Le caratteristiche chimiche variano dunque progressivamente e con continuità mentre ci spostiamo lungo un periodo, mentre rimangono sostanzialmente simili all'interno di un gruppo.
Possiamo inoltre suddividere la tabella periodica in quattro grandi regioni che rappresentano raggruppamenti di elementi che stanno inserendo elettroni in orbitali dello stesso tipo.
La prima regione (blocco s) è formata dai gruppi I A e II A dove si riempie l'orbitale s.
La regione all'estrema destra (blocco p), composta dai rimanenti sei gruppi A (l’ottavo gruppo A è spesso indicato come gruppo 0 (zero)) è costituita dagli elementi che distribuiscono i sei elettroni nei tre orbitali p.
La regione centrale (blocco d), costituita da 10 file verticali riunite a formare 8 gruppi B, è formata dai cosiddetti metalli di transizione, elementi che stanno disponendo 10 elettroni nei 5 orbitali d.
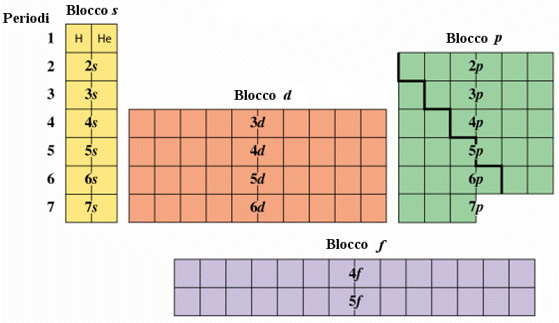
Infine la regione in basso (blocco f), formata da due serie orizzontali chiamate rispettivamente serie dei lantanidi e degli attinidi, è costituita da elementi che stanno distribuendo 14 elettroni nei 7 orbitali f (4f e 5f).
Gli atomi utilizzano prevalentemente gli elettroni del loro livello energetico più esterno (elettroni superficiali o elettroni di valenza) per interagire e legarsi tra loro. Il comportamento chimico di un atomo dipende dunque dal numero e dalla disposizione degli elettroni dell’ultimo livello energetico. Per capire la reattività di un atomo è dunque sufficiente conoscere la sua configurazione elettronica superficiale o configurazione dello strato di valenza.
Scrivendo, ad esempio, le configurazioni elettroniche superficiali degli elementi dei primi tre periodi chimici della tabella periodica, si osserva come gli elementi che si incolonnano in uno stesso gruppo chimico presentano la medesima configurazione elettronica superficiale.
La configurazione elettronica superficiale semplicemente si ripete periodicamente in livelli energetici via via più esterni.
Atomi di elementi diversi che presentino la medesima configurazione elettronica superficiale (il medesimo numero di elettroni sul loro ultimo livello) manifestano caratteristiche chimiche simili.
Così, ad esempio, lo Zolfo, che si trova sotto l’Ossigeno, presenta la medesima configurazione superficiale (ns2 np4) di quest’ultimo, sul terzo livello energetico (n = 3) invece che sul secondo (n = 2). Per questo motivo Zolfo ed Ossigeno hanno caratteristiche chimiche simili.
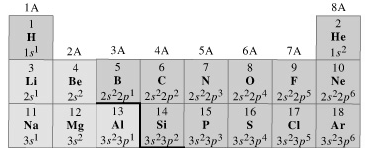
Dunque le caratteristiche simili degli elementi che appartengono ad uno stesso gruppo chimico dipendono essenzialmente dal numero di elettroni presenti sul livello energetico più superficiale, indipendentemente dal fatto che questo sia il primo, il secondo o l'ultimo.
Il numero d'ordine di ciascun gruppo indica quanti elettroni sono presenti nel livello energetico superficiale, dandoci quindi una prima indicazione di massima sul numero di elettroni disponibili per i legami chimici.
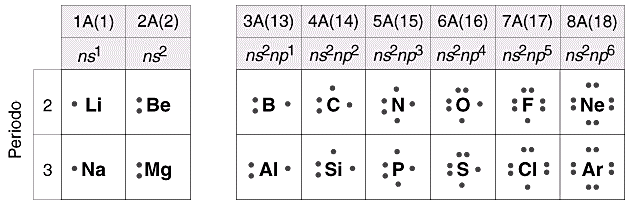
Così tutti gli elementi del primo gruppo A presentano configurazione elettronica superficiale ns1, dove n indica evidentemente il numero quantico principale.
Possiamo dunque costruire il seguente schema che ci permette di correlare ciascun gruppo A con la configurazione elettronica superficiale degli elementi appartenenti al gruppo stesso.
gruppo |
configurazione elettronica superficiale |
numero di elettroni |
I A |
ns1 |
1 |
II A |
ns2 |
2 |
III A |
ns2 np1 |
3 |
IV A |
ns2 np2 |
4 |
V A |
ns2 np3 |
5 |
VI A |
ns2 np4 |
6 |
VII A |
ns2 np5 |
7 |
VIII A |
ns2 np6 |
8 |
Gli elementi che possiedono 8 elettroni superficiali (configurazione otteziale) risultano particolarmente stabili, inerti, nel senso che manifestano pochissima tendenza a reagire con altri elementi chimici.
Gli altri elementi che possiedono configurazioni elettroniche simili a quella dei gas nobili tendono a perdere o ad acquistare elettroni per raggiungere tale configurazione particolarmente stabile. Molte reazioni chimiche possono essere spiegate proprio in virtù della tendenza di molti elementi ad acquisire la configurazione ad 8 elettroni superficiali dei gas nobili (regola dell'ottetto).
Spesso la configurazione elettronica di un elemento viene scritta in forma sintetica facendo riferimento al gas nobile che lo precede nella tabella periodica, e che presenta tutti i suoi livelli energetici completi, ed aggiungendo solo la configurazione superficiale dell’elemento.
Ad esempio le configurazioni di Ossigeno e Zolfo possono essere scritte così
Ossigeno 1s2 2s2 2p4 = [He]2s22p4
Zolfo 1s2 2s2 2p6 3s2 3p4 = [Ne]3s23p4
In altre parole, l’Ossigeno presenta la stessa configurazione elettronica dell’Elio più la sua configurazione superficiale, mentre lo Zolfo presenta la medesima configurazione elettronica del Neon più la sua configurazione superficiale.
I gruppi B vengono ordinati in analogia ai gruppi A. Il primo gruppo B che si forma viene detto III B e non I B in quanto la sua configurazione superficiale presenta 3 elettroni, 2 nell'orbitale s e 1 nell'orbitale d, in modo analogo a quanto avviene per gli elementi del gruppo III A.
Tranne alcune eccezioni anche per i gruppi B vale la regola che il numero d'ordine indica il numero di elettroni presenti nello strato più superficiale.
I lantanidi e gli attinidi hanno caratteristiche chimiche simili rispettivamente al lantanio e all'attinio e si suole perciò considerarli appartenenti al gruppo III B.
Nella maggior parte dei casi gli elettroni coinvolti nelle reazioni chimiche sono i 2 + 6 = 8 elettroni contenuti nell’orbitale s e nei tre orbitali p del livello energetico più esterno. Per questo motivo tali elettroni vengono convenzionalmente rappresentati utilizzando un metodo introdotto da Lewis.
Secondo tale metodo i 2 + 6 elettroni degli orbitali s e p del livello più esterno (elettroni di valenza) vengono rappresentati come punti o coppie di punti disposte ai quattro lati del simbolo chimico dell'elemento. Idealmente, ogni lato del simbolo chimico è associato ad un orbitale.
Per maggior chiarezza diamo la configurazione di Lewis o struttura di Lewis degli elementi appartenenti al 2° periodo.
Elemento |
Orbitale s |
Orbitali p |
Configurazione superficiale |
Configurazione di Lewis |
Litio |
|
|
2s1 |
|
Berillio |
|
|
2s2 |
|
Boro |
|
|
2s22p1 |
|
Carbonio |
|
|
2s22p2 |
|
Azoto |
|
|
2s22p3 |
|
Ossigeno |
|
|
2s22p4 |
|
Fluoro |
|
|
2s22p5 |
|
Neon |
|
|
2s22p6 |
|
Come si vede, le coppie di elettroni vengono più spesso rappresentate con una barretta.
E’ evidente che tutti gli elementi che appartengono ad un medesimo gruppo chimico, possedendo la medesima configurazione elettronica superficiale, presentano la stessa struttura di Lewis
E' possibile tracciare all'interno della tabella periodica una ideale linea obliqua che, passando per il Silicio (Si), l'Arsenico (As) ed il Tellurio (Te), va dal Boro (B) all'Astato (At) e divide tutti gli elementi in due grandi gruppi: a sinistra i metalli (più numerosi), a destra i non metalli. Le caratteristiche chimiche e fisiche dei metalli sono più accentuate all'inizio della tabella periodica e vanno lentamente sfumando mentre ci avviciniamo alla zona dei non metalli.
Gli elementi chimici che si trovano adiacenti alla linea di separazione presentano quindi caratteristiche intermedie tra quelle dei metalli e quelle dei non metalli e vengono per questo motivo chiamati semi-metalli. I metalli presentano una tendenza a perdere elettroni (si ossidano più o meno facilmente) trasformandosi in ioni positivi o cationi. Dal punto di vista fisico sono lucenti, tenaci (si rompono con difficoltà), duttili ( possono essere tirati in fili sottili), malleabili (possono essere tirati in lamine sottili), buoni conduttori di calore e di elettricità.
I non metalli presentano una tendenza ad acquistare elettroni (si riducono più o meno facilmente) trasformandosi in ioni negativi o anioni. Dal punto di vista fisico non sono lucenti, sono fragili, non presentano né duttilità, né malleabilità, sono cattivi conduttori o addirittura isolanti termici ed elettrici.
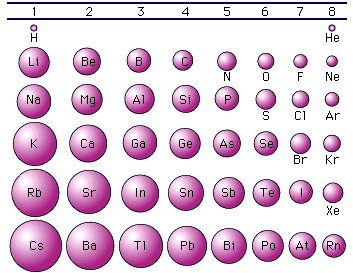
Le caratteristiche metalliche aumentano scendendo lungo un gruppo e spostandosi verso sinistra lungo un periodo. In tal modo gli elementi che presentano le caratteristiche metalliche più spiccate sono quelli in basso a sinistra della tabella periodica.
Evidentemente per ragioni opposte gli elementi che presentano le caratteristiche non metalliche più accentuate si trovano in alto a destra nella tabella periodica
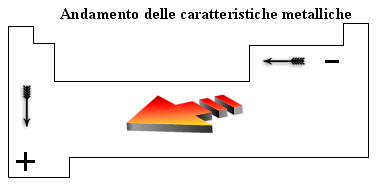
Possiamo trovare una semplice spiegazione di tale andamento analizzando come varia il raggio atomico. Osservando la tabella periodica è facile verificare che il raggio atomico, e quindi la distanza degli elettroni più superficiali dal loro nucleo, diminuisce da sinistra verso destra lungo un periodo mentre aumenta dall'alto in basso lungo un gruppo.
Infatti mentre ci spostiamo verso destra lungo un periodo gli elettroni vengono sistemati tutti in uno stesso livello energetico. La distanza di tale livello dal nucleo dovrebbe rimanere approssimativamente la stessa. In realtà poiché contemporaneamente aumenta anche il numero atomico Z, il nucleo esercita una attrazione via via maggiore sui livelli energetici occupati dagli elettroni, costringendoli a contrarsi verso il centro.
Quando invece ci muoviamo verso il basso lungo un gruppo ciascun elemento presenta i suoi elettroni superficiali su livelli energetici nuovi e via via più esterni, facendo in tal modo aumentare di scatto il raggio atomico
Ora è evidente che più distanti gli elettroni superficiali si trovano dal nucleo positivo e minore è la forza attrattiva che il nucleo stesso è in grado di esercitare su di essi. Ciò spiega in definitiva la maggior facilità con cui gli atomi metallici, che possiedono raggi atomici mediamente superiori rispetto ai non metalli, perdono i loro elettroni superficiali.
La tendenza a perdere elettroni da parte dei metalli è inoltre esaltata dal fatto che i metalli possiedono in genere pochi elettroni in più rispetto al gas nobile che li precede ed è per loro energeticamente più conveniente perderli piuttosto che acquistare un gran numero di elettroni per raggiungere la configurazione stabile del gas nobile che li segue nella tabella periodica.
Per ragioni opposte per i non metalli, che presentano in genere pochi elettroni in meno rispetto al gas nobile che li segue, è energeticamente più favorevole acquistarli piuttosto che perderne un gran numero.
La tendenza a perdere o ad acquistare elettroni da parte degli elementi chimici è misurata da due parametri fondamentali, l'energia di I ionizzazione e l'affinità elettronica, i cui valori si trovano tabulati nella tabella periodica.
Viene definita come l'energia, espressa in Kcal/mol (o KJ/mol), che è necessario fornire ad una mole di atomi allo stato gassoso per trasformarla in una mole di cationi monovalenti.
X(g) + EI ion (kJ/mol) → X+(g) + e-
L'andamento del valore di tale parametro nella tabella periodica ci conferma quanto abbiamo detto sulla maggior facilità con la quale i metalli perdono i loro elettroni.
L'energia di ionizzazione diminuisce infatti scendendo verso il basso lungo un gruppo, mentre cresce se ci spostiamo verso destra lungo un periodo.
Energia di Prima Ionizzazione (kJ mol-1) |
||||||||||||||||||
1 |
H |
|
He |
|||||||||||||||
2 |
Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
|||||||||
3 |
Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
|||||||||
4 |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
5 |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
6 |
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
7 |
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Uub |
Uut |
Uuq |
Uup |
Uuh |
Uus |
Uuo |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
Th |
Pa |
U |
Np 597 |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
Viene definita come l'energia liberata da una mole di atomi neutri allo stato gassoso quando si trasforma in una mole di anioni monovalenti.
X(g) + e- → X-(g) + AE (kJ/mol)
Tale definizione è contraria alla convenzione secondo la quale l’energia liberata durante una reazione ha segno negativo, generando spesso non poca confusione. Per questo motivo a volte si preferisce definire l’affinità elettronica come l’energia di ionizzazione degli ioni negativi, cioè come l’energia che deve essere fornita (quindi con segno positivo) ad uno ione negativo per strappargli il suo elettrone
X-(g) + EAE (kJ/mol) → X(g) + e-
L'andamento dei valori dell'affinità elettronica è analogo a quello del potenziale di Ia ionizzazione. Cresce lungo un periodo e decresce lungo un gruppo.
Affinità Elettronica (kJ mol-1) |
||||||||||||||||||
1 |
H |
|
He |
|||||||||||||||
2 |
Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
|||||||||
3 |
Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
|||||||||
4 |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
5 |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
6 |
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
7 |
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Uub |
Uut |
Uuq |
Uup |
Uuh |
Uus |
Uuo |
- numero atomico Z = numero di protoni presenti nel nucleo
- configurazione elettronica
- peso atomico relativo espresso in uma (o dalton) = rapporto tra il peso di un elemento (miscela dei suoi isotopi) ed 1/12 della massa del carbonio 12. Ricordiamo inoltre che il peso atomico relativo è numericamente pari al peso molare (PM) dell'elemento stesso.
Altre informazioni utili ottenibili dalla consultazione della tabella sono quelle relative al numero di ossidazione e all'elettronegatività degli elementi, di cui parleremo in seguito.
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve