I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Gli atomi tendono a raggiungere delle configurazioni energeticamente più favorevoli e stabili legandosi in raggruppamenti (molecole, reticolati ionici, reticolati metallici). In altre parole gli atomi si legano perché il composto che ne deriva è più stabile degli atomi separati.
La teoria del legame chimico si fonda, nella sua formulazione più semplice, sulla legge di Coulomb.
![]()
dove q sono le cariche elettriche, r la distanza che le separa ed F la forza (attrattiva per cariche opposte, repulsiva per cariche concordi) che si esercita su di esse.
Quando due atomi vengono avvicinati le nuvole elettroniche ed i nuclei interagiscono tra loro. Il legame è il risultato di un bilanciamento tra forze coulombiane attrattive (elettroni-nuclei) e repulsive (elettroni-elettroni e nuclei-nuclei).

Tuttavia tali forze risultano essere di intensità diversa per i diversi atomi e ciò porta alla formazione di legami con modalità differenti. Esistono tre modelli di legame (covalente, ionico, metallico) le cui caratteristiche dipendono essenzialmente dalla tendenza relativa che manifestano gli atomi coinvolti nel legame ad acquistare (affinità elettronica) o perdere elettroni (energia di ionizzazione).
Il legame covalente si presenta tipicamente tra atomi con elevata affinità elettronica (atomi di elementi non metallici)
Il legame ionico si presenta tipicamente tra atomi con elevata affinità elettronica (non metalli) ed atomi a bassa energia di ionizzazione (metalli)
Il legame metallico si presenta tipicamente tra atomi di elementi con bassa energia di ionizzazione (metalli)
Poiché, come abbiamo già detto, gli elettroni coinvolti nei legami chimici sono quelli che occupano il livello energetico più superficiale (elettroni di valenza), introduciamo un metodo semplice per rappresentarli, noto come configurazione di Lewis degli elementi.
Il legame covalente si forma tra atomi che presentano alta affinità elettronica e quindi tipicamente tra atomi non metallici.
Se il legame unisce atomi di un medesimo elemento, il legame si definisce covalente puro o covalente omeopolare.
Se il legame unisce atomi di elementi diversi, il legame si definisce covalente polare o covalente eteropolare.
La natura del legame covalente venne suggerita per la prima volta da G. Lewis, dell'università della California nel 1916.
Lewis attribuì l'inerzia chimica dei gas nobili al fatto di possedere 8 elettroni superficiali e avanzò quindi l'ipotesi che gli elementi che non presentavano la stessa configurazione elettronica esterna, tendessero a raggiungerla mediante la condivisione dei loro elettroni superficiali spaiati, al fine di raggiungere in tal modo una configurazione più stabile (regola dell’ottetto).
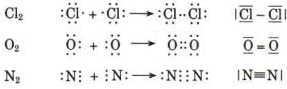
Prendiamo ad esempio due atomi di cloro, rappresentandoli mediante le loro strutture di Lewis. Essi hanno entrambi una configurazione 3s2 3p5, con un elettrone spaiato sull'ultimo orbitale p ed una forte tendenza ad acquistare un ulteriore elettrone (elevata affinità elettronica) per raggiungere la configurazione stabile del gas nobile successivo ( l'argon).
Possiamo pensare che entrambi i nuclei attirino fortemente l'elettrone spaiato dell'altro atomo senza peraltro riuscire a strapparlo.
Il risultato di questa intensa attrazione incrociata è che i due elettroni spaiati vengono alla fine condivisi da entrambi gli atomi ed il doppietto elettronico funge da legame, finendo per appartenere ad entrambi gli atomi.
I due atomi di Cloro “condividono” una coppia di elettroni e tale “condivisione” costituisce il legame covalente. In questo modo ora i due elettroni non appartengono più all'uno o all'altro atomo, ma ruotano entrambi intorno all'intera struttura molecolare biatomica.
Si dice che i due elettroni sono stati messi in comune o in compartecipazione.
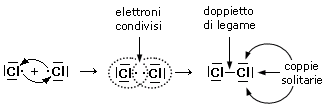
Ciascun nucleo "vede" ora intorno a sè i 6 elettroni non condivisi più i 2 elettroni condivisi per un totale di 8 elettroni. La condivisione di una coppia di elettroni permette a ciascun atomo di Cloro di raggiungere la configurazione stabile dell’ottetto.
Il legame che si forma per condivisione di una coppia di elettroni è detto legame covalente semplice o singolo e può essere rappresentato mediante una barretta che unisce i due simboli chimici. Gli atomi che formano la molecola di Cl2 sono quindi tenuti insieme da un legame covalente semplice
Cl - Cl
Le coppie di elettroni superficiali che non vengono condivise sono dette coppie (o doppietti) di non-legame o coppie solitarie (Lone Pairs).
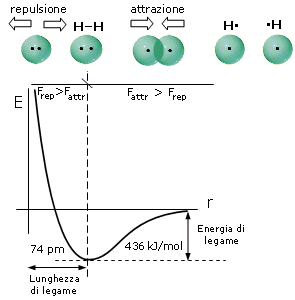
Come abbiamo già detto, durante il processo di formazione del legame si esercitano tra i due atomi sia forze attrattive (elettroni-nuclei) che forze repulsive (tra i nuclei, ma soprattutto tra i gusci elettronici). Le forze attrattive prevalgono a distanze maggiori, consentendo in questo modo ai due atomi di avvicinarsi e legarsi, mentre le forze repulsive diventano importanti e significative a corto raggio. L’energia potenziale del sistema (convenzionalmente posta uguale a zero quando i due atomi si trovano idealmente a distanza infinita) diminuisce man mano che le forze attrattive costringono i due atomi ad avvicinarsi.
Via via che i due atomi si avvicinano sia le forze attrattive che quelle repulsive diventano progressivamente più intense. Tuttavia, poiché le forze repulsive aumentano più rapidamente di quelle attrattive, si arriverà ad una distanza critica 8distanza di legame) in corrispondenza della quale le due forze risulteranno perfettamente uguali, l’energia potenziale raggiungerà il suo valore minimo ed il sistema sarà in equilibrio. Ogni ulteriore avvicinamento degli atomi causerà un aumento delle forze repulsive maggiore di quelle attrattive con conseguente tendenza del sistema a ritornare alla distanza di equilibrio.
Si tenga presente che la pendenza della curva dell’energia potenziale, rappresenta la forza netta (attrattiva + repulsiva) che agisce sugli atomi.
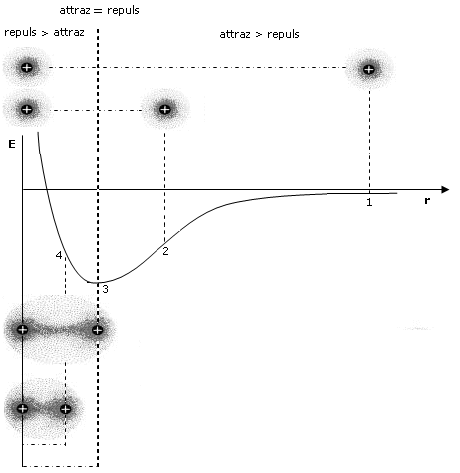
A grandi distanze (punto 1 del grafico) la curva dell’energia potenziale presenta piccole pendenze positive che corrispondono a deboli forze nette attrattive. Via via che gli atomi si avvicinano la pendenza della curva aumenta fino a raggiungere un valore massimo (punto 2 del grafico) in corrispondenza del quale le forze repulsive iniziano a crescere più rapidamente di quelle attrattive e la forza netta di attrazione inizia a diminuire. Alla distanza di legame (punto 3 del grafico) l’energia potenziale raggiunge il suo valore minimo e la forza netta è pari a zero (pendenza nulla e forze attrattive pari a quelle repulsive). A distanze inferiori (punto 4 del grafico) la curva dell’energia potenziale presenta pendenze negative crescenti che corrispondono ad intense forze repulsive nette.
Si può dunque dimostrare che, quando due atomi si avvicinano in risposta all'attrazione che ciascun nucleo esercita sull'elettrone spaiato dell'altro atomo, esiste una distanza critica in corrispondenza della quale la forza di attrazione viene esattamente bilanciata dalla repulsione che si produce tra i gusci elettronici negativi. Per distanze inferiori prevale la repulsione, per distanze maggiori prevale l'attrazione. Un modello semplice ed intuitivo, che descrive il fenomeno, rappresenta il legame come una molla che unisce i due atomi. Se si cerca di separarli la molla li richiama, se si cerca di avvicinarli troppo la molla li respinge, alla distanza di legame la molla non è in tensione.
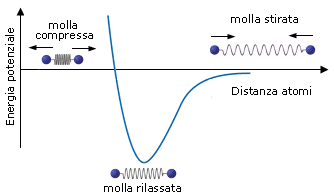
In corrispondenza della distanza di equilibrio viene quindi resa minima l'energia potenziale del sistema. Tale distanza corrisponde alla lunghezza di legame, parametro solitamente misurato in Ǻngström (1Ǻ = 10-10 m) o in picometri (1 pm = 10-12 m).
L'energia di legame, misurata in Kcal/mol (o in kJ/mol), è l’energia che si libera quando due atomi allo stato gassoso passano da distanza infinita alla distanza di legame ed ovviamente coincide con l'energia che è necessario fornire al sistema (allo stato gassoso) per rompere il legame, portando i due atomi a distanza infinita.
X-X(g) + Eleg (kcal/mol) → X•(g) + X•(g)
L’energia di legame è una misura della “forza” di un legame chimico (maggiore è l’energia di legame, più “forte” è un legame) e per questo motivo viene a volte impropriamente detta forza di legame.
Si consideri ad esempio la formazione del legame covalente in una molecola di H2.
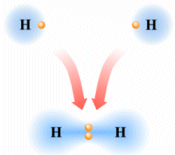
Due atomi di idrogeno condividono il loro unico elettrone per raggiungere la configurazione stabile dell’Elio.
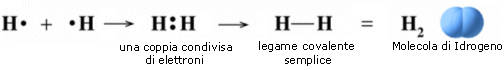
Nello schema successivo è rappresentato l’andamento dell’energia potenziale durante la formazione del legame.
Energia E (in kJ/mol) e Lunghezza L (in pm) di legame
|
||||||||||||||||||
|
E |
L |
|
|
E |
L |
|
|
E |
L |
|
|
E |
L |
|
|
E |
L |
H-H |
432 |
74 |
N-Cl |
313 |
175 |
C-Pb |
130 |
230 |
Ge-Ge |
188 |
241 |
S-S (S8) |
226 |
205 |
||||
H-B |
389 |
119 |
P-P |
201 |
221 |
C-N |
305 |
147 |
Ge-N |
257 |
|
S=S |
425 |
149 |
||||
H-C |
411 |
109 |
P-O |
335 |
163 |
C=N |
615 |
129 |
Ge-F |
470 |
168 |
S-F |
284 |
156 |
||||
H-Si |
318 |
148 |
P=O |
544 |
150 |
C≡N |
887 |
116 |
Ge-Cl |
349 |
210 |
S-Cl |
255 |
207 |
||||
H-Ge |
288 |
153 |
P=S |
335 |
186 |
C-P |
264 |
184 |
Ge-Br |
276 |
230 |
Se-Se |
172 |
|
||||
H-Sn |
251 |
170 |
P-F |
490 |
154 |
C-O |
358 |
143 |
Ge-I |
212 |
|
Se=Se |
272 |
215 |
||||
H-N |
386 |
101 |
P-Cl |
326 |
203 |
C=O |
799 |
120 |
Sn-F |
414 |
|
F-F |
155 |
142 |
||||
H-P |
322 |
144 |
P-Br |
264 |
|
C≡O |
1072 |
113 |
Sn-Cl |
323 |
233 |
Cl-Cl |
240 |
199 |
||||
H-As |
247 |
152 |
P-I |
184 |
|
C-B |
356 |
|
Sn-Br |
273 |
250 |
Br-Br |
190 |
228 |
||||
H-O |
459 |
96 |
As-As |
146 |
243 |
C-S |
272 |
182 |
Sn-I |
205 |
270 |
I-I |
148 |
267 |
||||
H-S |
363 |
134 |
As-O |
301 |
178 |
C=S |
573 |
160 |
Pb-F |
331 |
|
At-At |
116 |
|
||||
H-Se |
276 |
146 |
As-F |
484 |
171 |
C-F |
485 |
135 |
Pb-Cl |
243 |
242 |
I-O |
201 |
|
||||
H-Te |
238 |
170 |
As-Cl |
322 |
216 |
C-Cl |
327 |
177 |
Pb-Br |
201 |
|
I-F |
273 |
191 |
||||
H-F |
565 |
92 |
As-Br |
458 |
233 |
C-Br |
285 |
194 |
Pb-I |
142 |
279 |
I-Cl |
208 |
232 |
||||
H-Cl |
428 |
127 |
As-I |
200 |
254 |
C-I |
213 |
214 |
B-B |
293 |
|
I-Br |
175 |
|
||||
H-Br |
362 |
141 |
Sb-Sb |
121 |
|
Si-Si |
222 |
233 |
B-O |
536 |
|
Xe-O |
84 |
175 |
||||
H-I |
295 |
161 |
Sb-F |
440 |
|
Si-N |
355 |
|
B-F |
613 |
|
Xe-F |
130 |
195 |
||||
N-N |
167 |
145 |
C-C |
346 |
154 |
Si-O |
452 |
163 |
B-Cl |
456 |
175 |
|
|
|
||||
N=N |
418 |
125 |
C=C |
602 |
134 |
Si-S |
293 |
200 |
B-Br |
377 |
|
|
|
|
||||
N≡N |
942 |
110 |
C≡C |
835 |
120 |
Si-F |
565 |
160 |
O-O |
142 |
148 |
|
|
|
||||
N-O |
201 |
140 |
C-Si |
318 |
185 |
Si-Cl |
381 |
202 |
O=O |
494 |
121 |
|
|
|
||||
N=O |
607 |
121 |
C-Ge |
238 |
195 |
Si-Br |
310 |
215 |
O-F |
190 |
142 |
|
|
|
||||
N-F |
283 |
136 |
C-Sn |
192 |
216 |
Si-I |
234 |
243 |
S=O |
522 |
143 |
|
|
|
||||
Nella formazione di un legame covalente possono essere condivise anche più di una coppia di elettroni. E' il caso ad esempio delle molecole dell'ossigeno e dell'azoto.
L'ossigeno presenta 6 elettroni nell'ultimo livello con una configurazione elettronica superficiale 2s2 2p4, con due elettroni spaiati su due orbitali p. Per completare l'ottetto ciascun atomo di ossigeno condivide dunque 2 elettroni. Ciascun atomo di ossigeno ora "vede" intorno a sè 8 elettroni nel suo livello energetico più superficiale.
![]()
La molecola di O2 è quindi tenuta insieme da un legame covalente doppio. che può essere rappresentato con due trattini posti tra i simboli chimici dei due atomi (O = O)
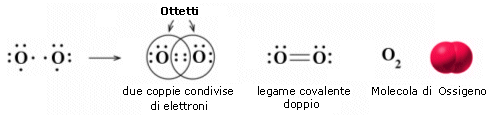
Un legame doppio è più corto e più forte di un legame semplice.
Nel caso dell'azoto la configurazione elettronica superficiale è del tipo 2s2 2p3, con tre elettroni spaiati su due orbitali p. Per completare l'ottetto ciascun atomo di Azoto deve dunque condividere 3 elettroni
![]()
Il legame che si forma e che tiene uniti gli atomi di Azoto in N2 è un legame covalente triplo che può essere rappresentato con tre trattini posti tra i simboli chimici dei due atomi (N ºN).
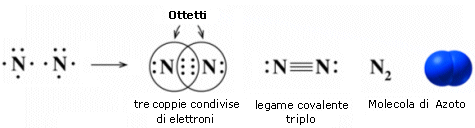
Un legame triplo è più corto e più forte di un legame doppio.
Riassumendo
Il numero di doppietti elettronici condivisi che tiene uniti due atomi è detto ordine di legame. Un legame singolo presenta ordine = 1, un legame doppio ordine = 2, un legame triplo ordine = 3.
La lunghezza del legame decresce all’aumentare dell’ordine di legame (un legame doppio è più corto di uno semplice ed uno triplo è più corto di uno doppio).
L’energia di legame aumenta all’aumentare dell’ordine di legame (un legame doppio è più forte di un legame semplice ed un legame triplo è più forte di un legame doppio).
Mentre i legami semplici permettono la libera rotazione degli atomi intorno all'asse di legame, i legami doppi e tripli non permettono rotazioni.
La lunghezza dei legami covalenti è correlabile al raggio covalente degli elementi.
Si definisce raggio covalente di un elemento la metà della lunghezza del legame covalente singolo che tiene uniti due atomi del medesimo elemento in una molecola neutra. In realtà tale definizione non si può applicare a tutti gli elementi.
L’ossigeno, ad esempio, forma una molecola O2 in cui i due atomi sono uniti da un legame di ordine = 2 (covalente doppio e non singolo). In questo caso si stima il raggio covalente analizzando molecole che contengano il gruppo -O-O-.
In altri casi si misura la lunghezza del legame A-X che un elemento X presenta con l’elemento A di cui è noto il raggio covalente e si stima il suo raggio covalente per differenza con il raggio covalente noto di A. Spesso si usa il Carbonio che si lega facilmente con molti elementi chimici e di cui è noto il raggio covalente.
Nel caso di elementi metallici, i cui atomi sono tenuti insieme da un legame metallico, si parla più propriamente di raggio metallico. Più in generale si parla di raggio atomico, covalente o metallico, in relazione al tipo di legame che tiene uniti gli atomi.
Raggio atomico (covalente e metallico) (in pm) |
|||||||||||||||||
H |
|
He |
|||||||||||||||
Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
|||||||||
Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
|||||||||
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Uub |
Uut |
Uuq |
Uup |
Uuh |
Uus |
Uuo |
Da quanto abbiamo fin qui visto ci si potrebbe attendere che il numero di legami covalenti che un atomo può formare non possa mai essere superiore al numero di elettroni spaiati che deve condividere al fine di completare l'ottetto. In realtà ciò è vero nella maggior parte dei casi, ma non in tutti.
In alcuni casi gli atomi riescono infatti a formare più legami di quanti apparentemente sembra loro consentito sulla base della loro configurazione elettronica superficiale. E' necessario tener presente che ogni legame in più che si forma produce un ulteriore aumento di stabilità della molecola e dunque gli atomi tendono a massimizzare il numero di legami formati.
La formazione di legami di tipo “dativo” ed i processi di “promozione elettronica” sono stati introdotti per giustificare la formazione di ulteriori legami rispetto al numero di elettroni spaiati di un atomo.
Legame dativo
Un legame covalente si può formare a partire da un doppietto elettronico messo a disposizione da un atomo donatore (o datore) e da un orbitale vuoto messo a disposizione da un atomo accettore.
Tale legame è detto legame covalente dativo ed una volta formatosi è indistinguibile da un normale legame covalente.
Il legame dativo può essere rappresentato come una freccia che va dal doppietto solitario dell’atomo datore D all’atomo accettore A.
D:→A
Si consideri ad esempio lo Zolfo e l'Ossigeno, entrambi appartenenti al VI gruppo A, aventi configurazione superficiale s2p4, con due doppietti, due elettroni spaiati e due elettroni mancanti per raggiungere la configurazione dell'ottetto.
![]()
Sulla base delle configurazioni superficiali dei due elementi ci potremmo attendere la formazione di un composto del tipo S=O, con formazione di un legame covalente doppio a seguito della condivisione di entrambi gli elettroni spaiati di ciascun elemento. In questo modo ciascun atomo completa infatti l’ottetto.
![]()
In realtà quando lo Zolfo reagisce con l’Ossigeno genera SO2 (anidride solforosa) ed SO3 (anidride solforica), riuscendo in tal modo a legare fino ad altri due atomi di ossigeno in più rispetto a quanto previsto.
Per giustificare la formazione di questi legami si ammette dunque che lo zolfo possa utilizzare per legarsi non solo gli elettroni spaiati, ma anche i doppietti solitari. Tuttavia l’Ossigeno non ha orbitali superficiali vuoti da poter utilizzare.
Si ammette quindi che l'Ossigeno possa subire una transizione dalla configurazione più stabile, prevista dalla regola di Hund ad una configurazione, meno stabile nella quale un elettrone viene spostato da un orbitale p semisaturo, generando un orbitale vuoto, all’altro orbitale p semisaturo.
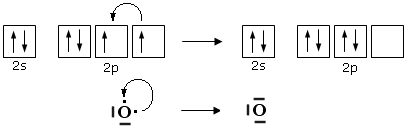
In questo modo l'ossigeno possiede ora un orbitale p vuoto che può utilizzare come accettore di un doppietto elettronico per formare un ulteriore legame chimico con lo zolfo di tipo dativo, per dare l’anidride solforosa SO2. Il passaggio dell’ossigeno ad una configurazione meno stabile richiede ovviamente energia, ma questa viene più che compensata dall’aumento di stabilità che si ottiene con la formazione di un ulteriore legame.
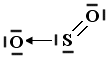
Nel caso lo Zolfo utilizzi entrambi i suoi doppietti solitari per formare due legami dativi con altrettanti atomi di ossigeno si forma l'anidride solforica SO3.
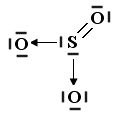
Il legame dativo ci permette di giustificare la capacità che hanno molti elementi ( in particolare gli elementi alla fine di un periodo) di formare un numero variabile di legami con l'ossigeno (valenza variabile) legandosi con esso in diverse proporzioni (legge delle proporzioni multiple di Dalton).
Il cloro, ad esempio, che possiede una configurazione superficiale s2 p5, presenta un elettrone spaiato e ben tre doppietti non condivisi disponibili per legami dativi. Si giustificano in tal modo l'esistenza di ben quattro composti ossigenati del cloro: l'anidride ipoclorosa Cl2O, l'anidride clorosa Cl2O3, l'anidride clorica Cl2O5 e l'anidride perclorica Cl2O7.
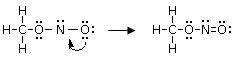
Non è necessario che un atomo liberi un orbitale per poter effettuare un legame dativo. In molti casi esistono già orbitali naturalmente liberi.
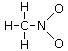
Un esempio si ha nella reazione di dissociazione ionica dell’acqua in ioni H+ e ioni OH-. In realtà in soluzione non esistono ioni H+ liberi poiché essi usano il loro orbitale 1s vuoto per legarsi, tramite legame dativo, ad uno dei due doppietti solitari dell’ossigeno di una molecola d’acqua, con formazione di ioni ossonio (o idronio) H3O+.
H2Ōı→H+ = H3O+
Una volta che lo ione ossonio si è formato, i 3 atomi di idrogeno sono perfettamente equivalenti ed i tre legami covalenti che li legano all’ossigeno risultano indistinguibili.
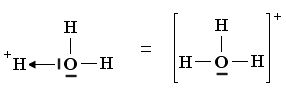
Ione ossonio
Promozione Elettronica
Come abbiamo appena visto, la formazione di legami stabilizza la molecola al punto che, in alcuni casi, un atomo può assumere configurazioni elettroniche meno stabili che tuttavia gli consentono di formare un maggior numero di legami. La promozione elettronica, ad esempio, è un processo di questo tipo, che consente ad un atomo di trasferire un elettrone da un orbitale superficiale saturo ad un orbitale superficiale vuoto. In questo modo un doppietto viene trasformato in due elettroni spaiati che, condivisi con altri atomi, possono essere utilizzati per formare due ulteriori legami chimici.
E’ il caso del Carbonio che, in quasi tutti i suoi composti promuove un elettrone dall’orbitale saturo 2s ad un orbitale 2p vuoto
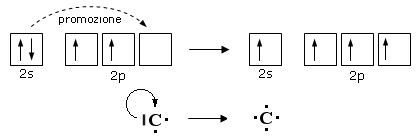
Pur passando da una configurazione elettronica superficiale più stabile ad una meno stabile, il Carbonio dispone ora di 4 elettroni spaiati (contro i due precedenti) che può condividere formando 4 legami chimici.
La promozione elettronica avviene quando la differenza di energia tra l’orbitale di partenza e quello di arrivo è piccola.
I legami covalenti sono direzionali, nel senso che essi formano tra loro angoli caratteristici che determinano la geometria della molecola. La geometria di una molecola e di conseguenza gli angoli di legame possono essere previsti in modo semplice applicando la teoria VSEPR (Valence-Shell Electron-Pairs Repulsion = repulsione tra doppietti elettronici dello strato di valenza).
Secondo tale teoria i doppietti elettronici più esterni (strato di valenza), essendo carichi negativamente, si respingono, tendendo a disporsi il più lontano possibile gli uni dagli altri, in modo da rendere minima la forza repulsiva e più stabile l'intera molecola.
La teoria prevede inoltre che i doppietti solitari (non impegnati in legami) tendano ad occupare un volume maggiore rispetto ai doppietti elettronici condivisi (impegnati in legami) ed esercitino pertanto una forza repulsiva più intensa. In prima approssimazione possiamo stilare la seguente graduatoria relativa dell'intensità della repulsione esercitata tra coppie di elettroni
repulsione tra coppie solitarie > repulsione tra coppie solitarie e coppie di legame > repulsione tra coppie di legame
Inoltre nella teoria VSEPR i legami doppi e tripli vengono considerati alla stregua di legami semplici e la geometria di una molecola dipende unicamente dal numero di legami (indifferentemente semplici, doppi o tripli) e di coppie solitarie che presenta l’atomo centrale (numero sterico)
numero sterico = numero legami + numero coppie solitarie
La geometria di una molecola è determinata dal suo numero sterico (NS)
Molecole con due soli legami e nessun doppietto solitario (AX2) risultano lineari, con le coppie di legame che, respingendosi, si dispongono equidistanti, formando angoli di legame di 180°
X―A―X
Come abbiamo detto, i legami possono essere indifferentemente singoli, doppi o tripli. Presentano, ad esempio, geometria lineare l’idruro di Berillio (BH2), l’anidride carbonica (CO2) e l’acido Cianidrico (HCN)
H―Be―H O=C=O H―C ≡ N
- Molecole con tre legami e nessun doppietto solitario (AX3) risultano trigonali planari, con le coppie di legame disposte equidistanti su di un piano, con angoli di legame di 120°. Presentano, ad esempio, geometria trigonale planare il cloruro di Boro (BCl3) e l’acetone (H2CO).
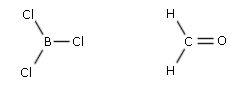
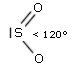
- Molecole con due legami ed un doppietto solitario (AX2E) risultano angolate, con un angolo di legame leggermente inferiore a 120° a causa della maggior repulsione del doppietto solitario sui doppietti di legame. Presenta una geometria angolata (derivata da una trigonale planare) l’anidride solforosa (SO2)
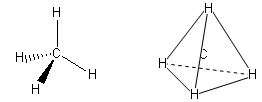
- Molecole con quattro legami e nessun doppietto solitario (AX4) risultano tetraedriche, con le coppie di legame disposte equidistanti ed angoli di legame di 109,5°. E’ il caso del metano (CH4). la cui molecola, come tutte le molecole tridimensionali, può essere rappresentata con legami a cuneo. Si utilizzano cunei pieni per rappresentare i legami che escono dal piano avvicinandosi all’osservatore e cunei tratteggiati per rappresentare i legami che si allontanano.
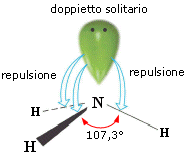
- Molecole con tre legami ed un doppietto solitario (AX3E) presentano una geometria piramidale di derivazione tetraedrica, con la coppia solitaria ad un vertice del tetraedro che comprime gli angoli di legame, portandoli ad un valore inferiore rispetto a quello caratteristico della geometria tetraedrica. E’ il caso dell’ammoniaca (NH3). la cui molecola piramidale presenta angoli di legame di circa 107°.
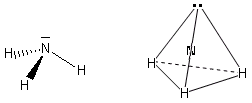
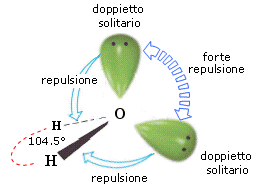
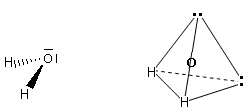
- Molecole con due legami e due doppietti solitari (AX2E2) presentano una geometria angolata di derivazione tetraedrica, con le due coppie solitarie ai due vertici del tetraedro che esercitano una forte repulsione e comprimono l’angolo di legame, portandolo ad un valore inferiore rispetto a quello caratteristico della geometria tetraedrica. E’ il caso dell’acqua (H2O). la cui molecola angolata presenta un angolo di legame di 104,5°.
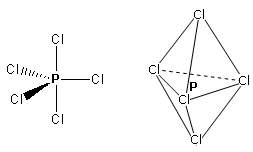
- Molecole con cinque legami e nessun doppietto solitario (AX5) risultano bipiramidali trigonali, con tre legami che si dispongono su di un piano (legami equatoriali) a 120° l’uno dall’altro e gli altri due legami (legami assiali) disposti perpendicolarmente, uno sopra e l’altro sotto al piano equatoriale, a formare due piramidi a base triangolare unite per la base. E’ il caso del Pentacloruro di Fosforo (PCl5).
- Molecole con sei legami e nessun doppietto solitario (AX6) risultano ottaedriche con quattro legami equatoriali distanziati di 90° e due legami equatoriali. Presenta questa geometria l’Esafluoruro di Zolfo (SF6).
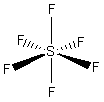
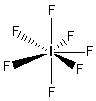
- Molecole con sette legami e nessun doppietto solitario (AX7) risultano bipiramidali con cinque legami equatoriali distanziati di 72° e due legami equatoriali. Presenta questa geometria l’Eptafluoruro di Iodio (IF7).
Naturalmente in tutte le strutture, l’eventuale presenza di doppietti solitari modifica la geometria originaria, comprimendo gli angoli dei legami residui.
Geometrie VSEPR |
|||||
|
Coppie solitarie |
||||
0 |
1 |
2 |
3 |
4 |
|
NS=2 |
lineare |
|
|
|
|
NS=3 |
Trigonale planare |
Angolata |
|
|
|
NS=4 |
Tetraedrica |
Piramidale trigonale |
Angolata |
|
|
NS=5 |
Bipiramidale trigonale |
Altalena o cavalletto (Seesaw o sawhorse) |
a forma di T |
Lineare |
|
NS=6 |
Ottaedrica |
Piramidale quadrata |
Planare quadrata |
a forma di T |
Lineare |
Quando gli elettroni vengono condivisi da atomi del medesimo elemento, ciascun atomo li attrae con la medesima intensità. In questo caso gli elettroni condivisi (elettroni di legame) possono essere immaginati come una nuvola negativa che si dispone in maniera uniforme e simmetrica intorno ai due nuclei senza produrre alcun tipo di polarità sulla molecola. Si parla in questo caso di legame covalente puro.
Nella maggior parte dei casi però gli atomi che formano il legame covalente appartengono ad elementi diversi che presentano una diversa forza di attrazione sugli elettroni di legame.
Si definisce elettronegatività χ (la lettera greca “chi”) la forza con cui un atomo attira a sé gli elettroni condivisi.
L'elettronegatività è una grandezza di difficile valutazione poiché, a differenza dell'affinità elettronica e dell'energia di ionizzazione che si riferiscono ad atomi isolati, l’elettronegatività si riferisce ad atomi legati ad altri atomi.
In generale il valore dell'elettronegatività può dunque variare, per uno stesso elemento, in relazione al tipo e al numero di atomi di altri elementi impegnati nel legame.
Nonostante ciò, al fine di avere a disposizione un parametro che permetta di valutare, anche se in modo approssimato, la polarità di un legame, sono stati proposti diversi metodi di calcolo per assegnare un valore di elettronegatività ai diversi elementi.
Tra i metodi più importanti vi sono quelli proposti da Mulliken e da Pauling.
L'elettronegatività secondo Mulliken è pari alla media aritmetica dell'energia di ionizzazione e dell'affinità elettronica.
![]()
L'elettronegatività secondo Pauling di un elemento A viene calcolata conoscendo l'elettronegatività di un elemento B attraverso la seguente relazione
![]()
Pauling ammette cioè che la differenza di elettronegatività tra due elementi sia uguale alla radice quadrata di una quantità Δ, detta energia di risonanza ionico-covalente espressa in eV, il cui valore è dato da
![]()
dove
DAB = energia di legame del composto A-B
DAA = energia di legame del composto A-A
DBB = energia di legame del composto B-B
![]() = media geometrica delle energie dei legami covalenti puri A-A e B-B, assunta come stima dell’energia di legame di un ipotetico legame covalente puro A-B
= media geometrica delle energie dei legami covalenti puri A-A e B-B, assunta come stima dell’energia di legame di un ipotetico legame covalente puro A-B
.
In altre parole, l'energia di risonanza ionico-covalente Δ misura la differenza di energia tra il legame covalente reale AB ed un ipotetico legame covalente puro AB.
Nel caso l'energia di legame sia espressa in kJ/mol o in kcal/mol è necessario applicare un coefficiente k di conversione (per trasformare in eV/particella), che vale rispettivamente 0,0103643 e 0,0433641.
![]()
Per poter utilizzare la relazione di Pauling è evidentemente necessario fissare arbitrariamente l'elettron egatività di un elemento che faccia da riferimento. Pauling assunse per l'idrogeno χ = 2,1.
Esempio Calcoliamo l'elettronegatività del Cloro secondo Pauling, sapendo che l'energia del legame H2 è 436 kJ/mol, del legame Cl2 è 242 kJ/mol e del legame HCl è 431 kJ/mol.
L'energia del legame HCl considerato come covalente puro è pari a
L'energia di risonanza ionica-covalente è pari
La differenza di elettronegatività calcolata è pertanto
Sapendo che l'elettronegatività dell'idrogeno è convenzionalmente 2,1 si ottiene per il Cloro
|
La scala di Mulliken è più rigorosa della scala di Pauling essendo costruita su grandezze misurabili. Nella pratica si usa però prevalentemente la scala di Pauling in quanto per molti elementi il valore dell'affinità elettronica è di difficile determinazione.
D'altra parte le due scale forniscono valori in gran parte coincidenti, risultando legate, anche se in modo approssimato, dalla seguente relazione
![]()
Esempio Calcoliamo l'elettronegatività del cloro secondo Mulliken sapendo che la sua energia di ionizzazione è pari a 1260 kJ/mol (13,1 eV/particella) e la sua affinità elettronica è pari a -349 kJ/mol (-3,6 eV/particella) e convertiamo il valore ottenuto nella scala di Pauling
trasformiamo ora il valore nella scala di Pauling
|
I valori di elettronegatività secondo Pauling si trovano tabulati nella tabella periodica e presentano il valore minimo in basso a sinistra (Francio = 0.7) e crescono diagonalmente fino ad assumere il valore massimo in alto a destra (Fluoro = 4).
Elettronegatività (Pauling) |
|||||||||||||||||
H |
|
He |
|||||||||||||||
Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
|||||||||
Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
|||||||||
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Uub |
Uut |
Uuq |
Uup |
Uuh |
Uus |
Uuo |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
Th |
Pa |
U |
Np 1.36 |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
E' evidente che tanto maggiore sarà la differenza di elettronegatività tra due elementi impegnati in un legame, tanto maggiore sarà la polarità del legame.
Dunque, quando si forma un legame covalente tra due atomi che presentano diversa elettronegatività la nube elettronica che costituisce il legame covalente risulta spostata verso l'atomo più elettronegativo. Quest'ultimo acquista pertanto una carica parzialmente negativa (indicata con -), mentre l'altro una carica parzialmente positiva (d+). La distribuzione asimmetrica della nuvola elettronica produce dunque due poli aventi carica opposta (dipòlo) ed il legame viene perciò definito covalente polare.
E’ ciò che accade, ad esempio nella molecola dell’acido Cloridrico (HCl) in cui l’Idrogeno condivide un elettrone con il Cloro. Il Cloro più elettronegativo presenta una parziale carica negativa e la molecola di HCl risulta polare
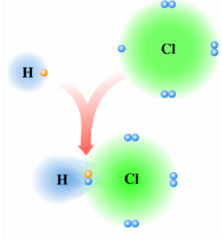
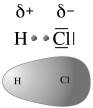
La distribuzione di carica elettrica di un dipolo può essere rappresentata tramite una mappa (o superficie) di potenziale elettrostatico (o densità elettronica) dove le tonalità del rosso indicano la carica negativa, quelle del blu la carica positiva, mentre il verde la neutralità.
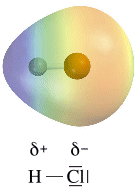
Maggiore è la differenza di elettronegatività (Δχ) tra i due elementi e maggiore sarà la polarità del legame (le cariche parziali saranno più vicine ad una intera carica).
Quando la differenza di elettronegatività tra i due elementi supera il valore critico di 1.9, si assume che l’elemento più elettronegativo sia in grado di strappare l’elettrone all’altro elemento ed il legame viene descritto come ionico. Possiamo dunque descrivere il legame ionico come un caso limite del legame covalente polare per Δχ > 1.9
L'intensità di un dipolo si esprime attraverso la determinazione del suo momento dipolare. Si definisce momento dipolare μ il prodotto della carica q associata ad uno dei baricentri di carica (la carica dell'altro baricentro ha valore uguale e di segno opposto) per la distanza r tra i baricentri.
μ = Q • r
L'unità di misura del momento dipolare è il debye (D).
Un momento dipolare presenta l'intensità di 1 debye quando 2 cariche elettriche di segno opposto, aventi intensità di 10-10 u.e.s. (unità elettrostatiche o franklin) si trovano alla distanza di 1 Å.
1 D = 10-10 ues Å = 3,335641·10-30 C m
Per caratterizzare la polarità di un legame covalente è possibile assegnargli una certa percentuale di carattere ionico, calcolabile in funzione del suo momento dipolare.
La percentuale di carattere ionico si calcola come rapporto percentuale tra il momento dipolare effettivo (misurato) ed il momento dipolare di un teorico legame ionico
![]()
Il momento dipolare di un ipotetico legame completamente ionico si calcola con
μionico = Qe• r = 4,8 • r
dove Qe è la carica dell'elettrone (e = 4,8 10-10 u.e.s.) ed r il valore della lunghezza del legame in Å.
Ad esempio, sapendo che il momento dipolare dell’acido cloridrico è μHCl = 1,1 D e la lunghezza del legame H-Cl è di 1,27 Å, si calcola
![]()
Sopra l’atomo di Cloro è presente una parziale carica negativa (d-) pari al 18% dell’intera carica dell’elettrone, mentre sopra l’atomo di Idrogeno sarà presente una parziale carica positiva (d+) della medesima intensità.
La polarità di un legame può anche essere stimata utilizzando la relazione di Pauling che correla la percentuale di carattere ionico alla differenza di elettronegatività (Δχ).
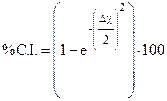
Ad esempio, sapendo che la differenza di elettronegatività tra Idrogeno e Fluoro è pari a Δχ = χF – χH = 4 - 2,2 = 1,8, possiamo stimare la percentuale di carattere ionico dell’acido fluoridrico
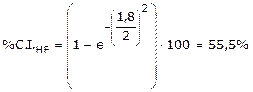
Il momento dipolare è una grandezza vettoriale, che viene rappresentata con una freccia orientata dal polo positivo al quello negativo.
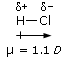
Nelle molecole in cui sono presenti più legami il momento di dipolo dell’intera molecola risulta essere la somma vettoriale dei momenti di dipolo dei singoli legami. Se il momento di dipolo risultante è diverso da zero allora la molecola è polare. Se il momento di dipolo risultante è uguale a zero, la molecola risulta apolare (anche se i suoi legami sono polari).
La polarità di una molecola dipende quindi non solo dalla polarità dei suoi legami, ma anche dalla sua geometria.
Così, ad esempio, se confrontiamo la polarità dell’anidride carbonica e dell’acqua, troveremo che mentre l’anidride carbonica è apolare, l’acqua è polare. L’anidride carbonica è infatti una molecola lineare ed il momento di dipolo dei suoi due legami risulta essere uguale e contrario, per cui il momento risultante è nullo.
L’acqua è invece una molecola angolata e la polarità dei suoi due legami si compone vettorialmente per dare un momento di dipolo diverso da zero. L’acqua è un dipolo.
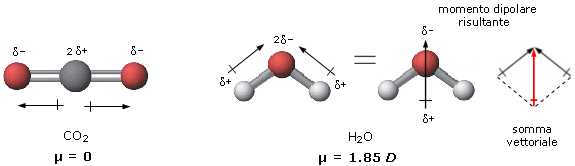
In effetti il momento dipolare totale di una molecola è dato dalla somma vettoriale non solo dei momenti dipolari relativi ai legami covalenti, ma anche ai dipoli associati alle coppie solitarie presenti nella molecola.
Una molecola polare è un minuscolo dipòlo il quale è in grado di ruotare orientandosi opportunamente se posto in un campo elettrico.
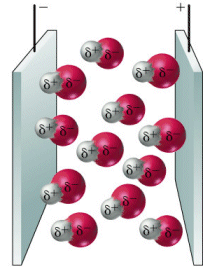
Dipoli orientati in un campo elettrico
Non sempre gli atomi utilizzano tutti i loro elettroni spaiati per effettuare legami chimici. In qualche caso può accadere che in una molecola sopravvivano degli orbitali insaturi.
Un tipico esempio di tale comportamento è rappresentato dal monossido di azoto.
![]()
Tutte le sostanze che si trovano a possedere un elettrone spaiato risultano essere paramagnetiche, vengono cioè debolmente attratte dai poli di un magnete. Tale comportamento è dovuto proprio al debole campo magnetico associato all'elettrone, non compensato in questo caso da un elettrone con spin opposto.
La convenzione introdotta da Lewis per rappresentare gli elettroni di valenza degli elementi viene utilizzata anche per rappresentare intere molecole. Per scrivere la struttura di Lewis di una molecola è necessario conoscere la sua formula molecolare e la connettività.
La formula molecolare e la connettività sono determinate sperimentalmente e devono essere note. La connettività o costituzione è l’ordine con cui gli atomi di una molecola sono connessi.
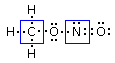
Ad esempio il nitrito di metile ha formula molecolare CH3NO2e la sua connettività è C-O-N-O con tutti gli idrogeni legati al carbonio.
Vediamo di seguito i 6 passaggi necessari per scrivere correttamente una struttura di Lewis molecolare. Useremo il nitrito di metile CH3NO2.
Per una molecola neutra, il numero di elettroni di valenza è uguale alla somma degli elettroni di valenza degli atomi coinvolti (elettroni superficiali che compaiono nella struttura di Lewis dell’elemento). Si ricordi che il numero di elettroni superficiali coincide in genere con il numero d’ordine del gruppo chimico al quale l’elemento appartiene. Così l’Ossigeno (VI gruppo A) possiede 6 elettroni di valenza, l’Azoto (V gruppo A) ne possiede 5, il Carbonio 4 (IV gruppo A) e l’Idrogeno 1 elettrone di valenza (I gruppo A).
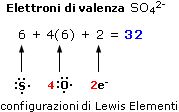
Per una molecola elettricamente carica il numero di elettroni di valenza è uguale al numero di elettroni di valenza degli atomi, al quale va sommato il numero delle cariche negative o sottratto il numero delle cariche positive. Ad esempio l’anione solfato SO42- possiede 32 elettroni di valenza (6 per l’atomo di Zolfo, 6 per ogni atomo di ossigeno e 2 per le due cariche negative dell’anione).
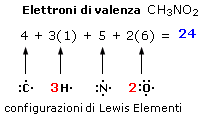
Il nitrito di metile (CH3NO2) presenta 24 elettroni di valenza. Ogni idrogeno contribuisce infatti con 1 elettrone di valenza, il carbonio con 4, l’azoto con 5 ed ogni atomo di ossigeno con 6 per un totale di 24 elettroni.
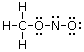
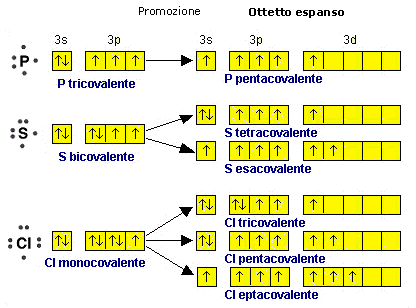
La regola per la quale ogni atomo legato deve avere non più di 8 elettroni superficiali (regola dell’ottetto) vale rigorosamente solo per gli elementi non metallici del secondo periodo chimico (C N O F) i quali, non possedendo orbitali d, non sono in grado di trasferirvi elettroni (promozione elettronica) per aumentare il numero dei loro legami. I primi elementi del secondo periodo possono avere meno di otto elettroni nel loro stato legato (4 per il Berillio e 6 per il Boro = ottetto incompleto). Gli elementi non metallici dei periodi superiori al secondo possono invece avere più di 8 elettroni superficiali (ottetto espanso) nel loro stato legato. In particolare quelli del gruppo V-A, come il Fosforo, possono avere 10 elettroni superficiali, mentre quelli del gruppo VI-A come lo Zolfo possono arrivare a 12 e quelli del gruppo VII-A, come il Cloro ne possono avere 14.
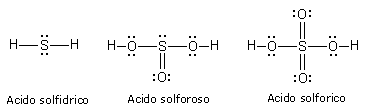
Ad esempio Lo Zolfo completa l’ottetto nell’acido solfidrico, mentre arriva a 10 elettroni nell’acido solforoso e a 12 elettroni nell’acido solforico
carica formale = elettroni di valenza atomo isolato – elettroni di valenza atomo legato
carica formale = elettroni di valenza – [½ elettroni di legame + elettroni solitari]
Naturalmente la somma delle cariche formali di tutti gli atomi di una molecola o ione deve essere uguale alla carica elettrica complessiva della molecola.
Per calcolare la carica formale sostituiamo i trattini che rappresentano i legami con coppie di puntini (i due elettroni condivisi) e successivamente contiamo gli elettroni intorno ai singoli atomi confrontandoli con i rispettivi elettroni di valenza degli atomi isolati
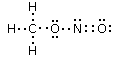
Intorno a ciascun atomo di ossigeno vi sono 6 elettroni. Poiché l’atomo di ossigeno isolato possiede 6 elettroni superficiali, i due atomi di ossigeno presentano carica formale nulla (6-6=0)
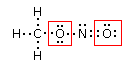
Intorno all’atomo di carbonio vi sono 4 elettroni, mentre intorno all’atomo di azoto vi sono 5 elettroni. Poiché gli atomi di carbonio e di azoto isolati possiedono rispettivamente 4 e 5 elettroni superficiali, la loro carica formale è nulla.
Esaminiamo ora il nitrometano, un composto che presenta la medesima formula molecolare del nitrito di metile CH3NO2, ma diversa connettività o costituzione (nitrometano e nitrito di metile sono due isomeri costituzionali). Nel nitrometano il carbonio si lega direttamente al’azoto il quale si lega ai due atomi di ossigeno. Il primo schema di legame è dunque il seguente
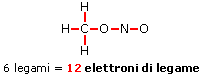
Abbiamo posizionato 6 legami per un totale di 12 elettroni. Gli elettroni di valenza sono sempre 24, come per il nitrito di metile (gli atomi sono gli stessi) e ci rimangono dunque altri 12 elettroni da posizionare. Assegnamo 3 doppietti solitari a ciascun atomo di ossigeno (più elettronegativo dell’azoto) in modo da raggiungere una configurazione ad 8 elettroni
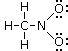
In questo modo l’azoto non presenta tuttavia l’ottetto completo (ha solo 3 legami per un totale di 6 elettroni) e quindi trasferiamo un doppietto solitario di uno dei due atomi di Ossigeno per formare un doppio legame N=O
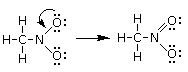
Calcoliamo ora la carica formale di ciascun atomo. Sostituiamo i trattini che rappresentano i legami con coppie di puntini (i due elettroni condivisi) e successivamente contiamo gli elettroni intorno ai singoli atomi (elettroni di valenza degli atomi legati)
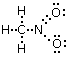
L’atomo di ossigeno con il doppio legame presenta 6 elettroni, di cui 2 elettroni per i due legami e 4 per i due doppietti solitari). Avendo l’ossigeno isolato 6 elettroni di valenza la sua carica formale è nulla. L’atomo di ossigeno con il legame semplice presenta invece 7 elettroni, di cui 1 elettrone per il legame e 6 per i tre doppietti solitari. Avendo dunque un elettrone in più rispetto ai 6 elettroni di valenza di un atomo di ossigeno isolato, la sua carica formale è -1.

L’atomo di Azoto presenta 4 elettroni (metà degli 8 elettroni che formano i suoi 4 legami) Avendo dunque un elettrone in meno rispetto ai 5 elettroni di valenza di un atomo di Azoto isolato, la sua carica formale è +1.

L’atomo di Carbonio presenta 4 elettroni (metà degli 8 elettroni che formano i suoi 4 legami) Avendo dunque il medesimo numero di elettroni di un atomo di carbonio isolato, la sua carica formale è nulla.

La formula di Lewis del nitrometano sarà pertanto
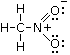
Si rammenti che una formula di Lewis non è completa se non presenta le corrette cariche formali.
La teoria del legame di valenza (Valence Bond Theory) fu proposta nel 1927 da W.Heitler e F.London e successivamente ampliata e sviluppata da L.Pauling con l’introduzione dei concetti di risonanza (1928) e di ibridazione orbitalica (1930). La teoria interpreta la formazione del legame covalente mediante il concetto quantomeccanico di orbitale.
Il legame covalente, che nella teoria di Lewis viene visto come una condivisione da parte di due atomi di una coppia di elettroni, viene descritto come una sovrapposizione degli orbitali atomici che ospitano i due elettroni spaiati da condividere.
Le funzioni d’onda dei due orbitali si sommano (in modo analogo ai fenomeni di interferenza per le onde meccaniche) per dare una nuova funzione d’onda che descrive un nuovo orbitale.
Il nuovo orbitale appartiene ad entrambi gli atomi legati ed ospita i due elettroni con spin antiparallelo.
Nel caso del legame covalente semplice che tiene uniti due atomi di Idrogeno nella molecola H2, ad esempio, abbiamo una sovrapposizione di due orbitali 1s. Se indichiamo i due atomi di Idrogeno con HA e HB, le due funzioni d’onda che si sommano sono ΨA(1s)e ΨB(1s)
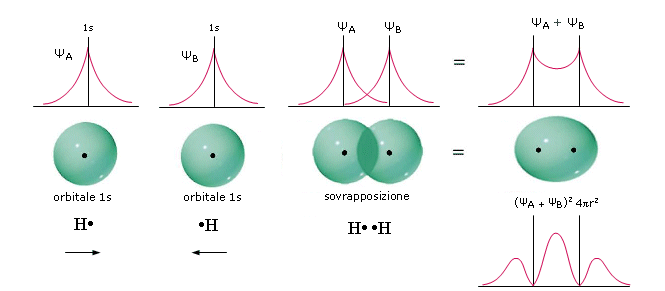
La funzione di distribuzione radiale della densità elettronica (probabilità) del nuovo orbitale che si è formato mostra un massimo tra i due nuclei. Si suppone che, quando gli atomi di H si avvicinano, ciascun elettrone condiviso possa passare da un nucleo all’altro, cioè che a distanze ravvicinate i nuclei non ‘distinguano’ gli elettroni di legame.
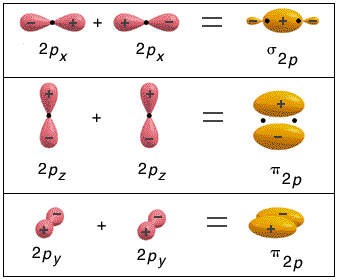
Nel formare i legami gli orbitali, se possibile, tendono a massimizzare la regione di sovrapposizione. Gli orbitali di tipo p, ad esempio, tendono a sovrapporsi lungo il loro asse maggiore. Nella molecola biatomica del Fluoro F2, ad esempio, due orbitali 2p si sovrappongono lungo l’asse maggiore, utilizzando i lobi aventi il medesimo segno, in modo che la funzione d’onda tra i due nuclei si rinforzi, aumentando la densità elettronica.

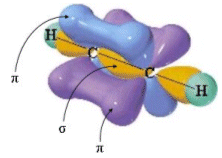
Questo tipo di sovrapposizione genera un legame covalente particolarmente intenso, detto legame σ.
Nel caso di legami covalenti doppi e tripli, solo una coppia di orbitali p può generare un legame σ. Gli altri orbitali p, essendo disposti uno perpendicolarmente all’altro, sono costretti a sovrapporsi lateralmente (lungo l’asse minore). Questo tipo di legame covalente è più debole (a causa della minor sovrapposizione) ed è detto legame π.
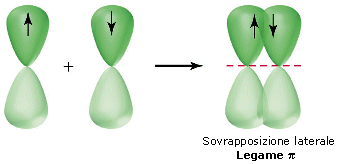
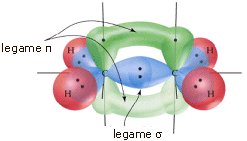
Quando in una molecola si forma un legame covalente doppio si genera un legame σ lungo la congiungente i due nuclei ed un legame π costituito da due nuvole elettroniche disposte simmetricamente (sopra e sotto) rispetto al legame σ. Un doppio legame è una struttura rigida e non consente la libera rotazione dei due atomi legati attorno all’asse di legame.
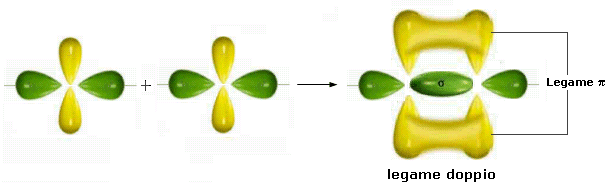
Il legame doppio è quindi più forte di un legame semplice, ma presenta tuttavia una forza inferiore a quella di due legami semplici essendo costituito da un legame σ (più forte) ed un legame π (più debole).
Quando in una molecola si forma un legame covalente triplo si genera un legame σ lungo la congiungente i due nuclei e due legami π costituiti da quattro nuvole elettroniche disposte simmetricamente ai quattro lati del legame σ (un legame sopra-sotto ed un legame davanti-dietro). Anche un triplo legame è una struttura rigida e non consente la libera rotazione dei due atomi legati attorno all’asse di legame.
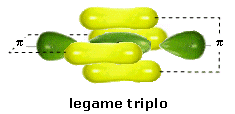
In una molecola biatomica come l’azoto (N2), ad esempio, in cui due atomi di Azoto sovrappongono tre coppie di orbitali p formando un legame covalente triplo, gli orbitali px si compenetrano lungo la congiungente i due nuclei formando un legame di tipo σ, mentre gli altri orbitali p si sovrappongono lateralmente dando origine a due legami π che presentano un massimo di densità elettronica sopra e sotto l’asse internucleare.
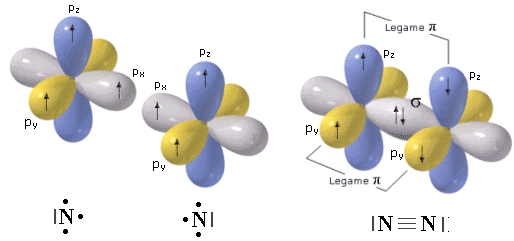
Il legame triplo è quindi più forte di un legame semplice, ma presenta tuttavia una forza inferiore a quella di tre legami semplici essendo costituito da un legame σ (più forte) e da due legami π (più deboli).
In definitiva, nel caso in cui la densità elettronica si concentri sull’asse internucleare, si parla di legame σ, nel caso si concentri sopra e sotto l’asse internucleare si parla di legame π.
I legami σ presentano una simmetria cilindrica e sono quindi invarianti per rotazione attorno all’asse di legame.
I legami π non sono cilindricamente simmetrici rispetto all'asse di legame, poiché la funzione d’onda cambia di segno per rotazione attorno all’asse.
Presentano simmetria σ anche i legami che si formano per sovrapposizione di due orbitali s, come nella molecola H2, o per sovrapposizione di un orbitale s con un orbitale p, come nella molecola HCl.

Per formare legami, gli atomi possono ricombinare gli orbitali atomici (s,p,d) per dar luogo ad un ugual numero di orbitali atomici detti orbitali ibridi. Questo processo, detto ibridazione, è un procedimento di combinazione matematica delle funzioni d’onda originarie.
L’ibridazione interessa orbitali superficiali (di valenza) con contenuto energetico non molto diverso. Gli orbitali ibridi così formati sono tutti di uguale forma ed energia e sono orientati in modo da interferire il meno possibile fra di loro, massimizzando la reciproca distanza.
Gli orbitali ibridi più importanti sono quelli che si formano dalla combinazione di un orbitale s con uno o più orbitali p. La superficie di contorno di tali orbitali ibridi è costituita da due lobi contrapposti di diversa dimensione in cui la funzione d’onda Ψ assume segno opposto. Il lobo di dimensione maggiore è quello che viene utilizzato nei legami.
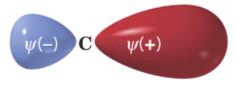
La combinazione di un orbitale di tipo s e uno di tipo p dà origine a due orbitali ibridi detti orbitali sp
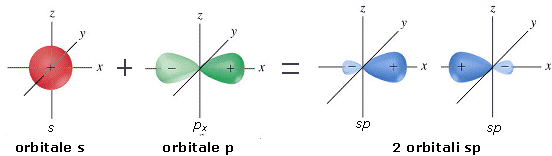
Gli orbitali sp si dispongono a 180° l’uno rispetto all’altro. Nella visione d’insieme spesso si omette di rappresentare il lobo minore di ciascun orbitale ibrido.
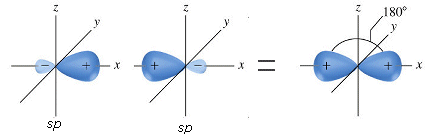
Gli orbitali p non ibridati si orientano perpendicolarmente alla retta di ibridazione e perpendicolarmente tra loro.
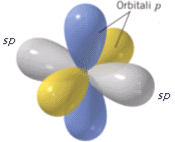
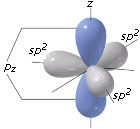
L’ibridazione sp è tipica di molecole con una geometria lineare. Presentano un’ibridazione sp l’atomo di Berillio nell’idruro di Berillio (BH2), l’atomo di carbonio nell’anidride carbonica (CO2) e gli atomi di carbonio uniti da un legame covalente triplo (-C≡C-) come ad esempio nella molecola dell’etino HC≡CH
Etino
Va detto che, per semplicità, si disegnano normalmente gli ibridi con il piano nodale passante per il nucleo, mentre il nucleo si trova in una zona a densità elettronica non nulla.
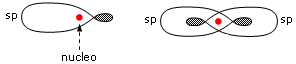
La combinazione di un orbitale di tipo s e di due orbitali di tipo p dà origine a tre orbitali ibridi detti orbitali sp2 che si dispongono su di un piano a 120° l’uno dall’altro.
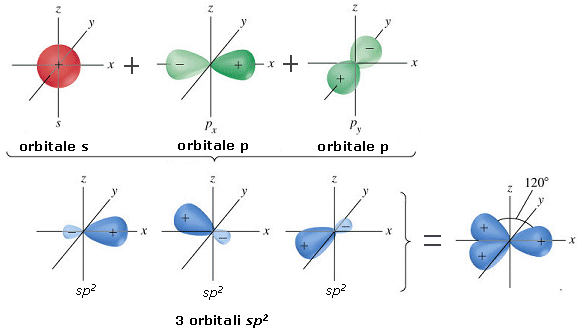
L’orbitale p non ibridato si dispone perpendicolarmente al piano di ibridazione.
L’ibridazione sp2 è tipica di molecole con una geometria trigonale planare. Presentano un’ibridazione sp2 l’atomo di Boro nel cloruro di Boro (BCl3) e gli atomi di carbonio uniti da un legame covalente doppio (>C=C<), come ad esempio nella molecola dell’etene (o etilene) H2C=CH2
Etene
La combinazione di un orbitale di tipo s e di tre orbitali di tipo p dà origine a quattro orbitali ibridi detti orbitali sp3 che puntano verso i vertici di un tetraedro, disponendosi a 109,5° l’uno dall’altro.
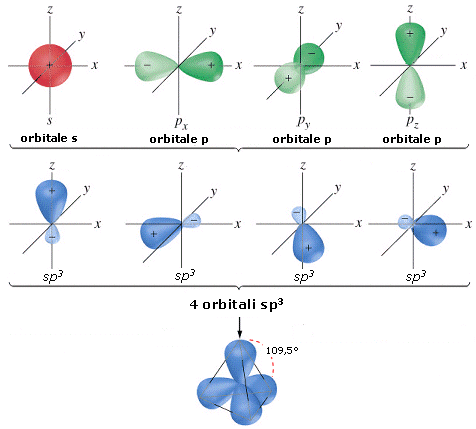
L’ibridazione sp3 è tipica di molecole con una geometria tetraedrica. Presenta un’ibridazione sp3 l’atomo di Carbonio nel metano (CH4) ed in tutti i casi in cui forma quattro legami covalenti semplici.
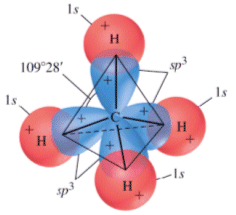
Metano
Sono possibili ibridazioni più complesse che coinvolgono anche gli orbidali d e che corrispondono alle geometrie già studiate con la teoria VSEPR.
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve