I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
I MATTONI DELLA MATERIA: In natura possiamo trovare un numero enorme di sostanze diverse. L'unità fondamentale di ciascuna di esse è il risultato della combinazione più o meno complessa di minutissime particelle chiamate atomi. Vi sono un centinaio di tipi diversi di atomi in natura, molti naturali (92), alcuni artificiali (poco più di 10). Sono dunque relativamente pochi i tipi di atomi, ma le maniere con cui essi si possono combinare sono numerosissime e ciascuna di esse dà luogo ad una specifica sostanza.
Per definizione un atomo è la parte più piccola di un elemento che ancora lo caratterizza. Gli elementi dunque in natura sono tanti quanti i tipi diversi di atomi: circa un centinaio. Tutti gli atomi di uno stesso elemento sono dello stesso tipo e sono di tipo diverso da quello degli atomi di un altro elemento.
LA STRUTTURA DELL'ATOMO: L'atomo è una particella elettricamente neutra. Nel suo interno però esistono particelle positive, i protoni, e particelle negative, gli elettroni, vi sono inoltre delle particelle elettricamente neutre, i neutroni. Protoni e neutroni si trovano al centro dell'atomo a formare il nucleo. Per quanto la massa dei protoni e dei neutroni sia circa 2000 volte maggiore di quella degli elettroni, il nucleo occupa una parte piccolissima dell'intero volume atomico, protoni e neutroni infatti stanno vicinissimi all'interno del nucleo; l'enorme spazio che costituisce il resto del volume atomico è invece occupato solo dagli elettroni. La carica positiva di un protone è uguale in valore assoluto alla carica negativa di un elettrone e se l'atomo è nel suo insieme elettricamente neutro se ne deduce che in un atomo il numero di protoni è uguale a quello degli elettroni. Questo numero viene chiamato numero atomico e viene indicato con “Z”. Per definizione il numero atomico (Z) indica il numero di protoni presenti nel nucleo di un atomo. I tipi diversi di atomi si distinguono proprio grazie al loro diverso numero atomico: due atomi diversi avranno diverso numero di protoni, due atomi uguali avranno lo stesso numero di protoni. Il numero di massa indica il numero di particelle che formano il nucleo (esso è dato dunque dalla somma del numero di protoni e del numero di neutroni dell'atomo) e viene indicato con “A”. A differenza del numero atomico, il numero di massa non identifica un elemento: vi possono essere infatti atomi dello stesso elemento che, in quanto tali hanno lo stesso numero di protoni ma che contengono un diverso numero di neutroni: questo fenomeno si chiama isotopismo ed isotopi vengono detti gli atomi con lo stesso numero di protoni ma diverso numero di neutroni.
LA TAVOLA PERIODICA: Nella tavola periodica si trovano i simboli di tutti gli elementi Il simbolo rappresenta un atomo di un elemento. Il simbolo può esser formato da una sola lettera maiuscola o da due lettere, in tal caso la prima è maiuscola e la seconda è minuscola. Nella tavola periodica i simboli degli elementi sono ordinati secondo il loro numero atomico Z, da sinistra verso destra e dall'alto verso il basso, a cominciare, in alto a sinistra, dal simbolo dell'idrogeno (H) che ha Z=1. Le righe della tavola periodica sono chiamate periodi, le colonne sono chiamate gruppi. Le ragioni per le quali i simboli degli elementi sono raccolti in periodi ed in gruppi verranno via via chiarite durante il corso di chimica, certo è che ad ogni elemento è associata una casella che si trova sempre nella stessa posizione (riga/colonna) in qualsiasi tavola periodica. A seconda poi dell'uso che se ne vuol fare e dell'accuratezza con cui viene presentata la tavola periodica, le caselle possono essere più o meno ricche di notizie. Al minimo comunque una tavola periodica presenta il simbolo ed il numero atomico, essi sono in netta evidenza dal momento che identificano univocamente l'elemento. Spesso è presente anche un numero che indica la massa atomica (il nostro libro lo chiama ancora “peso atomico”) dell'elemento: esso non indica la massa di un atomo di quell'elemento, dal momento che essa è variabile, a seconda del numero di massa (A) di ciascun nucleo (ricorda il fenomeno dell'isotopismo!): essa rappresenta la media ponderata delle masse dei vari isotopi di quell'elemento così come sono presenti in natura. L'unità di misura della massa atomica è chiamata “unità di massa atomica” ed è indicata con “u” nel nostro libro. Tale unità di massa naturalmente è piccolissima dal momento che è comoda da usare per particelle così piccole come gli atomi: ci vogliono circa sei centinaia di migliaia di miliardi di miliardi di “u” per fare un grammo! Attenzione a non confondere il numero atomico con la massa atomica: il primo lo si riconosce perché è un numero intero, il secondo è decimale con due o più cifre dopo la virgola a seconda dell'accuratezza della tavola periodica.
IONI: A volte accade che un atomo possa perdere un certo numero di elettroni (di solito uno o due, più raramente tre, eccezionalmente quattro, a seconda dell'elemento): in tal caso l'atomo si trasforma in ione positivo (catione). Infatti il numero di elettroni non è più uguale a quello dei protoni del nucleo. Tanti sono gli elettroni persi altrettante cariche positive restano libere, non neutralizzate, e determinano la carica del catione. L'elemento è sempre lo stesso (NB: non accade nulla al nucleo, il numero atomico non cambia (ricorda la definizione di numero atomico!) ma non è più allo stato atomico ma è allo stato di ione.
Accade anche che un atomo possa acquistare elettroni (di solito uno o due), in tal caso esso si trasforma in ione negativo (anione). Le cariche elettroniche sono in eccesso rispetto a quelle del nucleo, l'elemento passa dallo stato atomico a quello di ione tante volte negativo quanti sono gli elettroni acquistati.
I MATTONI DELLA MATERIA:
a) E' la parte più piccola della materia
b) E' la parte più piccola di una sostanza che ne mantiene le sue caratteristiche chimiche e fisiche
c) E' la parte più piccola di un elemento e in quanto tale non può più essere divisa
d) E' la parte più piccola di una sostanza che ancora la caratterizza.
e) E' la parte più piccola di un elemento che ancora lo caratterizza.
f) E' la parte più piccola di un elemento che ne mantiene le sue caratteristiche chimiche e fisiche
LA STRUTTURA DELL'ATOMO:
Fai riferimento all'atomo di un elemento con Z=2 e A=5. Esegui le seguenti consegne:
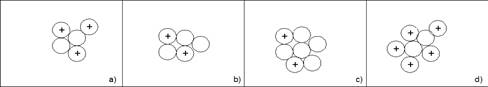
a) Si allontanano rispettivamente un neutrone ed un protone?
b) Si allontana un protone?
c) Si allontana un neutrone?
d) Si aggiunge un protone?
e) Si aggiunge un neutrone?
LA TAVOLA PERIODICA:
a) I simboli chimici utilizzati per i diversi elementi sono uguali in tutto il mondo
b) Tutti i simboli chimici sono rappresentati da due lettere
c) I simboli chimici sono abbreviazioni utilizzate per rappresentare gli elementi
d) I simboli chimici sono formati da una o due lettere e solo la prima lettera si scrive in maiuscolo.
a) Se l'atomo di un elemento con Z=3 e A=7 perde un elettrone?
b) Se l'atomo di un elemento con Z= 8 e A=16 acquista due elettroni?
c) Se l'atomo di un elemento con Z=12 e A=25 perde due elettroni?
Fonte: http://www.voltatrieste.gov.it/docs/downloads/Chimica%20concetti%20di%20base.doc
Sito web da visitare: http://www.voltatrieste.gov.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve