I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Sali e acidi complessi appartengono ad un vasto gruppo di composti detti "complessi". In generale un composto complesso si forma quando ad un atomo o ad un catione metallico centrale si legano, con legami di tipo dativo, più molecole di una sostanza detta "complessante", avente una o più coppie di elettroni non condivisi da impegnare. Gli agenti complessanti, detti anche "leganti", sono anioni o sostanze neutre.
Si dice che il catione centrale "coordina" intorno a sé le molecole leganti. Per questo motivo i composti complessi sono anche detti composti di coordinazione.
I più comuni leganti anionici sono
Legante Prefisso
F- fluoro-
Cl- cloro-
Br- bromo-
I- iodio-
S2- tio- (solfo-)
CN- ciano- (CN)
NC- isociano- (NC)
SCN- tiocianato- (SCN)
NCS- isotiocianato- (NCS)
OH- idrossi-
O2- osso- (oxo-)
NO2- nitrito- (ONO)
|
NO2- nitro-
SO42- solfato-
I più comuni leganti neutri sono
H2O acquo-
NH3 ammino-
NO nitrosil- (NO)
CO carbonil- (CO)
I cationi che più facilmente formano complessi sono quelli che presentano le più elevate densità di carica (ione piccolo con carica elevata). Il numero di leganti che un catione è in grado di coordinare è detto numero di coordinazione dello ione complessante.
Il numero di coordinazione di gran lunga più frequente è il 6. Abbastanza comuni anche il 2 e il 4. Molto più rari i numeri dispari.
Il numero di coordinazione di un catione è quasi sempre pari al doppio del suo nox più elevato.
Ad esempio
il Ferro (nox +2, +3) presenta numero di coordinazione 6
il Rame (nox +1, +2) presenta numero di coordinazione 4
l'Argento (nox +1) presenta numero di coordinazione 2
il Cobalto (nox +2, +3) presenta numero di coordinazione 6
I complessi esacoordinati sono ottaedrici
I complessi tetracoordinati sono tetraedrici o quadrati planari
I complessi bicoordinati sono lineari
Ad esempio si ritiene che nello ione complesso esammino cromico, Cr(NH3)63+, lo ione Cr3+, che presenta la seguente configurazione superficiale
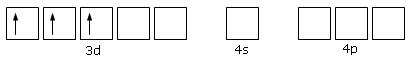
formi 6 orbitali ibridi sp3d2, per i quali la teoria VSEPR prevede appunto una disposizione ottaedrica.
Questi 6 orbitali vuoti sarebbero dunque disponibili per formare 6 legami dativi con altrettante molecole di ammoniaca.
regole convenzionali per la scrittura di un complesso
1) prima si scrive il metallo (agente complessante)
2) poi si scrivono i leganti in ordine alfabetico preceduti dal prefisso che ne indica il numero (mono-, di-, tri-, tetra- etc)
anioni complessi: il metallo con desinenza -ato, seguito dal suo nox in numeri romani tra parentesi, secondo la notazione di Stock, codificata dalla convenzione IUPAC (International Union of Pure and Applied Chemistry) oppure, secondo la vecchia terminologia, il metallo con desinenza -ato o -ito in relazione al suo nox
Fe(CN)64- anione esacianoferrato (II) (leggi: esacianoferrato due)
oppure
anione esacianoferrito
Fe(CN)63- anione esacianoferrato (III) (leggi: esacianoferrato tre)
oppure
anione esacianoferrato
cationi complessi: il metallo seguito dal suo nox in numeri romani tra parentesi, secondo la notazione di Stock, codificata dalla convenzione IUPAC oppure, il metallo con desinenza -oso o -ico, in relazione al suo nox
Cu(NH3)42+ ione tetraammino rame (II)
oppure
ione tetraamminorameico
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve