I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Come si è arrivati al calcolo del numero di Avogadro?
Gli atomi come pure le molecole si combinano e hanno reazioni chimiche tra singole particelle. Quindi ciò che interessa è sapere il numero di atomi o molecole coinvolte nelle reazioni chimiche e non il loro peso.
Esempio:
![]()
2 atomi di idrogeno si combinano con 1 atomo di ossigeno formando una molecola di acqua. Ora, nella pratica comune, si ha sempre a che fare con quantità molto più grandi di atomi e molecole e quindi si è interessati a definire una unità di misura che permetta di correlare le unità di massa (p.e. grammi) con i rapporti di reazione degli elementi. Queste unità di misura sono rispettivamente : grammoatomi e grammomolecole
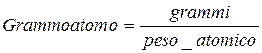
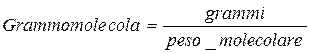
Da cui 2 grammoatomi di idrogeno si combinano con 1 grammoatomo di ossigeno per dare una grammomolecola di acqua, ovvero:
2 grammoatomi H * 1,01 = 2,02 grammi H (1,01 è il peso atomico dell’idrogeno)
1 grammoatomo O * 16,0 = 16,0 grammi O (16,0 è il peso atomico dell’ossigeno)
1 grammomolecola H2O * 18.02 = 18,02 grammi acqua
2,02 grammi di idrogeno si combinano con 16,0 grammi di ossigeno per dare 18,02 grammi di acqua.
A questo punto non resta che definire il numero di Avogadro cioè quante sono le molecole presenti in una grammomolecola (mole)?
Questo problema è stato risolto in maniera sperimentale constatando che un atomo di radio ![]() disintegrandosi produce una particella a e dà luogo alla formazione di un atomo di elio. È stato misurato sperimentalmente che
disintegrandosi produce una particella a e dà luogo alla formazione di un atomo di elio. È stato misurato sperimentalmente che ![]() disintegrazioni (che producono altrettanti atomi di elio) occupano un volume di 0,0433 ml (in condizioni normali).
disintegrazioni (che producono altrettanti atomi di elio) occupano un volume di 0,0433 ml (in condizioni normali).
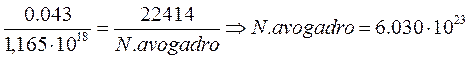
Dopo questa prima determinazione sperimentale sono state fatte innumerevoli altre determinazioni nei più svariati modi ricavando il seguente valore sperimentale:![]()
Fonte: http://bovara.altervista.org/lezioni/numero_avogadro.doc
Sito web da visitare: http://bovara.altervista.org
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve