I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Inizialmente la velocità della reazione diretta sarà maggiore della velocità della reazione inversa (Vdir > Vinv), ma poichè con il procedere della reazione i reagenti diminuiscono ed i prodotti aumentano e le velocità di reazione sono proporzionali alle concentrazioni, la velocità della reazione diretta è destinata a diminuire mentre la velocità della reazione inversa è destinata ad aumentare.
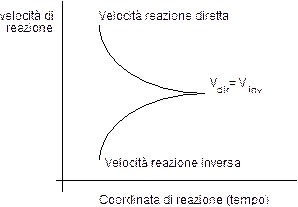
Ad un certo punto si giungerà ad un equilibrio dinamico, cioè al punto in cui la velocità con cui i reagenti si trasformano in prodotti è pari alla velocità con cui i prodotti si trasformano in reagenti. In altre parole
![]()
e quindi
![]()
dove le concentrazioni delle specie chimiche sono quelle che compaiono al raggiungimento dell'equilibrio. La reazione sembra dunque ferma, anche se in realtà essa continua senza che vi sia una modificazione nelle concentrazioni raggiunte.
La relazione di equilibrio viene più spesso data sotto la seguente forma
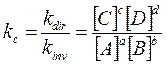
dove le concentrazioni sono sempre le concentrazioni delle specie chimiche all'equilibrio e kc, essendo ottenuta come rapporto di due costanti (costante di velocità specifica inversa e diretta) è una nuova costante, detta costante di equilibrio.Il suo valore è caratteristico per ogni reazione e varia solo in funzione della temperatura, mentre è indipendente da ogni altra condizione (pressione, concentrazione, catalizzatori etc).
Tale relazione è fondamentale nella descrizione degli equilibri chimici ed è nota come legge di azione di massa o legge di Guldberg-Waage.
La legge di azione di massa afferma dunque che in una reazione che ha raggiunto l'equilibrio, il rapporto tra il prodotto delle concentrazioni dei prodotti e quello dei reagenti, ciascuna elevata al proprio coefficiente stechiometrico è una costante.
Quando la reazione avviene tra sostanze gassose torna utile esprimere la costante di equilibrio come rapporto tra le pressioni parziali. La costante che si ottiene è detta kp.
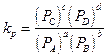
tenendo conto che la pressione parziale del reagente A vale
![]()
e che la stessa relazione vale anche per tutte le altre specie chimiche gassose, possiamo esprimere la kp in funzione delle molarità dei singoli reagenti
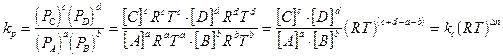
Dove n è la differenza tra i coefficienti stechiometrici dei prodotti di reazione e i coefficienti stechiometrici dei reagenti. Tale relazione ci permette di affermare che, per una medesima reazione, il valore di kc coincide con il valore di kp solo se reagenti e prodotti sono presenti con lo stesso numero di moli.
Il valore assunto dalla costante di equilibrio (kc o kp) ci informa se la reazione avviene in modo più o meno completo.
Se il valore della costante di equilibrio è elevato (in genere molto maggiore di 1) ciò significa che il numeratore è molto più grande del denominatore: l'equilibrio viene cioè raggiunto quando le concentrazioni dei prodotti di reazione sono molto maggiori delle concentrazioni dei reagenti. In tal caso si dice che l'equilibrio è spostato verso destra (verso i prodotti).
Se il valore della costante di equilibrio è basso (in genere molto minore di 1) ciò significa che il numeratore è molto più piccolo del denominatore: l'equilibrio viene cioè raggiunto quando le concentrazioni dei reagenti sono molto maggiori delle concentrazioni dei prodotti di reazione . In tal caso si dice che l'equilibrio è spostato verso sinistra (verso i reagenti).
Si tenga presente che il valore della costante di equilibrio non da alcuna indicazione sulla velocità della reazione, la quale dipende essenzialmente dall'energia di attivazione, dalla temperatura e dalle concentrazioni dei reagenti.
I valori delle costanti di equilibrio si trovano tabulati per le diverse reazioni. Conoscendole possiamo ricavare le concentrazioni delle specie chimiche all'equilibrio.
ESEMPIO
Introduciamo 2 moli di H2 e 0,8 moli di I2 in un recipiente di 1,6 litri e portiamo la temperatura a 763°K per produrre le reazione
H2 + I2 « 2HI
sapendo che a 763°K la kc = 46 si vuole sapere quanto acido iodidrico si forma
se indichiamo con X le moli di idrogeno che reagiscono con X moli di iodio per litro, all'equilibrio si formeranno 2X moli/l di acido iodidrico.
costruiamo allora la seguente tabella
concentrazioni iniziali concentrazioni all'equilibrio
H2 2/1,6 = 1,25 mol/l 1,25 - X mol/l
I2 0,8/1,6 = 0,5 mol/l 0,5 - X mol/l
HI 0 mol/l 2X mol/l
Utilizziamo ora i valori delle concentrazioni di equilibrio, espresse in funzione di X, all'interno delle legge di azione di massa
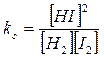
e, sostituendo opportunamente le concentrazioni di equilibrio
![]()
si ottiene un'equazione di secondo grado che risolta fornisce le seguenti due radici
X1 = 1,442 X2 = 0,475
La prima va scartata non avendo significato fisico (è superiore alla concentrazione iniziale).
La concentrazione di equilibrio dell'acido iodidrico sarà pertanto pari a
![]()
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve