I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
DISPENSA DI MECCANICA QUANTISTICA
Introduzione
In questa sezione ci proponiamo di dare uno sguardo a una delle teorie scientifiche più interessanti ma nello stesso tempo enigmatiche elaborate nel corso del novecento, la Meccanica Quantistica. Tale teoria nacque quasi per caso, in seguito allo studio di un problema secondario della Fisica classica, la radiazione del corpo nero, ed ebbe il suo più rapido sviluppo tra gli anni '20 e '40 di questo secolo, grazie all'interesse dimostrato verso questa nuova branca della Fisica da parte dei migliori fisici teorici della prima metà del novecento, come ad esempio Niels Bohr, Werner Heisenberg, Erwin Schrödinger, Paul Dirac, e grazie anche alla venerabile tenacia di un'intera generazione di fisici sperimentali, che incuranti della notevole distanza tra la neonata e misteriosa meccanica dei quanti e i principi secolari della solida meccanica newtoniana, si dedicarono allo studio delle interazioni tra luce e materia nei primi e pionieristici laboratori di fisica nucleare.
Insieme alla teoria della relatività e alle geometrie non euclidee, infatti, la meccanica quantistica rappresenta un vero e proprio stacco nei confronti della visione tradizionalmente deterministica del mondo tramandataci dai tempi di Newton: così come Einstein dimostrava l'inesattezza delle leggi della meccanica classica, i fisici che si interessarono di meccanica quantistica dimostravano come nel mondo dell'infinitamente piccolo le definizioni di onda, corpuscolo, posizione, andassero strette ai nuovi "oggetti quantistici" come l'elettrone e il fotone, e che si potessero utilizzare per una loro definizione approssimativa, mutuata dalla meccanica classica, la quale però certamente non ne restituiva fedelmente l'essenza fisica.
Altro fatto sconcertante, fu il venir meno del principio di causalità: la meccanica quantistica, al contrario della meccanica newtoniana, non offre certezze, ma si basa su una visione probabilistica degli eventi fisici, che non deriva dalla necessità di sintetizzare il comportamento di un grandissimo numero di particelle elementari che nel loro singolo si comportano in maniera deterministica. Grazie alla formulazione del principio di indeterminazione, la probabilità diventa una caratteristica intrinseca di ogni singolo oggetto quantistico, il cui comportamento è sempre soggetto a un certo margine di incertezza. Risulta comunque necessario distinguere tra caso soggettivo e caso oggettivo. Siamo di fronte ad un evento soggettivamente casuale quando di esso non si conosce la causa, ma questa deve esserci (ad esempio, in un primo momento non siamo in grado di individuare le cause di un incidente aereo, ma queste devono evidentemente esserci, e vengono scoperte a seguito di indagini e studi). La casualità oggettiva caratterizza un fenomeno di cui non solo non si conosce la causa, ma essa non c'è, e la sua assenza non è imputabile a una mancanza del nostro sistema di indagine ma alla presenza di una casualità pura, di una situazione che non può essere inquadrata nel principio di correlazione tra causa ed effetto, che pur essendo un'idea efficacissima nell'interpretare il mondo fisico, è pur sempre frutto del fatto che gli uomini per capire il mondo impongono ad esso i propri schemi concettuali. Ma nel caso della meccanica dei quanti, il principio di causalità è del tutto impotente. Questa incertezza che caratterizza i fondamenti della materia, gli oggetti microscopici, di cui si occupa la meccanica dei quanti, potrebbe far pensare a un mondo retto dal caso. Su questa idea hanno peraltro discusso una moltitudine di filosofi.
Per quanto i principi della meccanica quantistica possano sembrare non intuitivi, perché di fatto lontani da quella che è la nostra esperienza quotidiana con gli oggetti macroscopici, dei quali ad esempio possiamo tranquillamente individuare la posizione e la velocità con una precisione limitata sostanzialmente solo dai limiti strumentali e di prontezza dell'essere umano (e quindi esterni all'oggetto fisico in sé), si è resa necessaria fin dagli anni '20 una conciliazione tra meccanica classica e quantistica. La soluzione è data dal Principio di Corrispondenza di Bohr, che sulla falsariga dell'idea nel campo della meccanica macroscopica, per cui le previsioni della meccanica classica continuano ad essere accettate come caso particolare di quelle della meccanica relativistica per le basse velocità, afferma che le leggi della meccanica quantistica devono concordare con quelle della meccanica classica a mano a mano che il sistema in esame passa da dimensioni microscopiche a dimensioni macroscopiche. Insomma quando le leggi quantistiche sono applicate alla realtà macroscopica, devono dare lo stesso risultato delle leggi classiche. Ciò rivela una sorta di asimmetria tra leggi classiche e quantistiche: le prime sono applicabili al mondo microscopico, mentre le seconde non riescono a descriverlo. Da ciò deriva l'idea delle leggi quantistiche come leggi fondamentali della materia, di cui le leggi classiche sono un'approssimazione per grandi dimensioni.
Nonostante questa riconciliazione tra classico e quantistico, rimane il problema del contrasto tra la razionalità di qualsiasi uomo dotato di una normale dose di buonsenso, e l'a-causalità che sta alla base della nuova teoria. Tale questione è seria e generò un acceso dibattito tra Niels Bohr, forte sostenitore della nuova teoria, e il padre della relatività, Albert Einstein. Quest'ultimo era ancora fortemente legato a una visione deterministica della Fisica, non accettava l'idea della presenza costante del caso oggettivo all'interno di una teoria scientifica. In verità non arrivava a concepire l'esistenza di qualcosa che trascendesse dal principio di causalità, faro di ogni disciplina scientifica. Sebbene Einstein non negasse il valore scientifico della teoria, era lungi dal considerarla completa, ossia in grado di spiegare ogni fenomeno fisico. Tale era invece la posizione di Bohr e di altri fisici come Heisenberg e Born, nota come interpretazione di Copenhagen, che attribuiva alla meccanica quantistica, così com'era, con la sua caratterizzazione probabilistica, lo status di teoria scientifica completa. La posizione di Einstein è riassumibile nelle parole scritte da lui in una lettera a Max Born nel 1926:
"La teoria è potente, ma non ci avvicina molto di più ai segreti del Vecchio. Ad ogni modo, io sono convinto che Lui non giochi ai dadi"
L'idea che la meccanica quantistica così come era stata formulata da Heinsenberg, Dirac e Schrödinger non fosse ancora completa, che la sua caratterizzazione probabilistica fosse dovuta a variabili nascoste, ossia a leggi e parametri non ancora scoperti continuò a farsi strada fino ad un poderoso lavoro del 1932 del matematico John von Neumann, il quale dimostrò la non esistenza di eventuali variabili nascoste. Nonostante questa vittoria per l'interpretazione di Copenhagen, non erano pochi allora coloro che si opponevano alla visione della meccanica quantistica di Bohr e Heisenberg: oltre a Einstein, altri eminenti fisici come de Broglie, che elaborò una versione deterministica della meccanica quantistica, abbandonata poi dallo stesso autore.
Per quanto al profano possa sembrare inaccettabile una teoria scientifica che implichi un'incertezza di fondo, ciò che è veramente sicuro è che la meccanica quantistica funziona perfettamente nella descrizione delle dinamiche del mondo particellare e nucleare, ed è alla base di numerose scoperte e applicazioni tecnologiche nel campo dell'elettronica, della chimica, dell'informatica e della medicina. Ora come ora, dopo un secolo dalla nascita di questa teoria, per dirla con le parole del fisico americano Richard Feynman "è forte il sospetto che questa limitazione ci inseguirà per sempre, e che è impossibile risolvere il rompicapo, e che la natura è proprio così. La meccanica quantistica resiste, perigliosa ed esatta".
Schematizziamo qui il nostro discorso, per facilitare la comprensione, in vari argomenti:
- La dualità Onda-Corpuscolo
- Principio di Pauli
- Principio di Indeterminazione
- L’equazione di Schrodinger.
La dualità onda-corpuscolo e la meccanica dei quanti
Abbiamo già parlato del lungo confronto tra la teoria corpuscolare e quella ondulatoria della luce. Proprio mentre si dava ormai per certa la natura ondulatoria della radiazione luminosa, Thomson scoprì l'elettrone e la sua natura corpuscolare, e soprattutto Einstein estese l'idea di quanto anche alla luce, con l'idea del fotone. Ciò implicava evidentemente un'interpretazione corpuscolare della luce. Prendendo atto delle evidenze sperimentali, si iniziò quindi a parlare di dualità onda-corpuscolo.
Dopo la quantizzazione dell'energia, un altro vero e proprio terremoto nella Fisica classica fu provocato dagli studi del fisico francese Louis Victor de Broglie: partendo dall'idea della dualità onda-corpuscolo della radiazione luminosa, ipotizzò che questa doveva essere la manifestazione particolare di un principio naturale della natura. Così come la radiazione luminosa presenta una natura palesemente ondulatoria, ma può comportarsi come un insieme di corpuscoli, così le particelle, come ad esempio l'elettrone e il protone, che sono dei corpuscoli (sono dotati di massa) possono comportarsi in determinate circostanze come delle onde. Tale ipotesi è riassunta nella relazione:
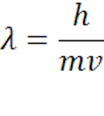
dove λ rappresenta la lunghezza d'onda di un corpuscolo materiale di massa (m) e velocità (v). Tramite la costante di Planck, il brillante fisico francese metteva in relazione la massa, fino ad allora la caratteristica peculiare della materia, con la lunghezza d'onda, parametro della radiazione, facendo crollare l'assunto-base della fisica classica, ossia la netta distinzione all'interno della realtà fenomenica tra la materia e la radiazione.
Gli esperimenti della doppia fenditura
Un modo per rendersi conto della correttezza dell'ipotesi avanzata da de Broglie è considerare gli esperimenti con fenditura. Essi consistono nel proiettare dei corpi contro una barriera insuperabile, nella quale sono aperti due fori piuttosto vicini tra loro. Oltre tale barriera è disposto un rivelatore, la cui natura specifica dipende dal tipo di corpo proiettato, in modo da indicare il punto in cui arriva il corpo che è eventualmente passato da una delle fenditure.
In generale, per illustrare le diverse caratteristiche dei fenomeni ondulatori e di quelli riguardanti corpi solidi, si possono considerare due esperimenti di questo tipo: nel primo si immagina che a dover passare dalle fenditure siano delle onde d'acqua, mentre nel secondo si considerano dei corpi solidi come ad esempio dei proiettili.
Nel caso delle onde il grafico delle distribuzioni di probabilità indica l'intensità dell'onda nei vari punti del rivelatore: essa non è la semplice somma delle intensità quando si considerano i due casi di una fenditura aperta e l'altra chiusa, ma il suo andamento mostra un'interferenza, tipica dei fenomeni ondulatori. Ossia l'onda, giunta alle due fenditure, è come se si scomponesse e da ogni fenditura si generasse una distinta sorgente di onde, le quali interferiscono con quelle emesse dall'altra fenditura, andando a descrivere l'andamento delle intensità totale (intensità dell'onda che passa per entrambe le fenditure così come è rilevata). Tale andamento è quindi quello tipico dei fenomeni ondulatori.
Nel caso invece dei proiettili (ad esempio dei sassi), trattandosi di corpi solidi, essi passano solo da una fenditura, per cui la probabilità totale che un proiettile, dopo aver superato una delle due fenditure, venga rilevato in un certo punto del rivelatore è data dalla somma delle singole probabilità considerando separatamente chiuse prima una poi l'altra fenditura. Tale curva di probabilità, più semplice per assenza di fenomeni di interferenza, è quella tipica dei corpuscoli.
Fin qui nulla di eccezionale. I problemi iniziano quando consideriamo una particella sub-atomica, come ad esempio l'elettrone.
Innanzitutto dobbiamo tenere presente che la natura corpuscolare dell'elettrone era già stata dimostrata dagli esperimenti di Thomson. Ci aspetteremmo quindi una distribuzione delle probabilità totale (probabilità tenuto conto che entrambe le fenditure sono aperte) analoga a quella dei proiettili. Andando a compiere l'esperimento si vede però che la curva della probabilità totale è invece simile a quelle dell'intensità delle onde, e non è quindi la semplice somma delle probabilità singole con una delle due fenditure chiuse, ma siamo in presenza di figure di interferenza.
Possiamo quindi affermare che l'ipotesi di elettrone come corpuscolo è errata? Verifichiamo ciò con un ulteriore esperimento. Posizioniamo una sorgente luminosa dietro la barriera, tra una fenditura e l'altra. In tal modo potremo controllare da dove passa ogni elettrone, con il metodo "per che via?". Ciò è possibile considerando che le cariche elettriche diffondono la luce: l'elettrone, venendo a contatto con i fotoni della fonte luminosa appena sistemata, diffonderà esso stesso un po' di luce. A seconda della fenditura attraversata, vedremo quindi un bagliore in corrispondenza di una delle due fenditure: l'elettrone è passato da quella.
Innanzitutto si vede come non vi siano mai due lampi contemporaneamente. Ciò è un fatto molto importante, che dimostra come l'elettrone, al contrario del fronte d'onda che si espande e può transitare contemporaneamente attraverso le due fenditure, si comporta come un corpuscolo indivisibile che passa solo da una fenditura. Ma c'è un altro fatto interessante. La distribuzione delle probabilità totali è ora analoga a quella dei proiettili, ossia senza nessuna figura di interferenza. Questa seconda esperienza sembra dunque confermare la natura corpuscolare dell'elettrone.
Il motivo di una tale discrepanza tra i risultati dei due esperimenti è dato dall'utilizzo della sorgente luminosa: infatti come conseguenza dell'effetto Compton, non si può trascurare l'interazione tra i fotoni (dotati di una certa energia) e particelle di massa molto piccola come gli elettroni. Tale interazione, che avviene sotto forma di urti elastici, genera un'alterazione non trascurabile nel moto degli elettroni. Si può pensare allora di aumentare la lunghezza d'onda della radiazione emessa dalla sorgente luminosa, per avere fotoni meno energetici, che non "disturbino" gli elettroni. In tal modo nello stesso esperimento avremmo la conferma sperimentale della natura ondulatoria (le figure di interferenza sul rilevatore) e insieme corpuscolare (il lampo che si avverte da una sola fenditura alla volta), degli oggetti quantistici, che è lo scopo di questo esperimento.
Ma subito si presenta un problema sperimentale: nel momento in cui la lunghezza d'onda della sorgente luminosa supera come valore la distanza tra le due fenditure, si ha un bagliore indistinto al passaggio dell'elettrone. Ciò è dovuto alla natura ondulatoria della luce, per cui la distanza minima per vedere due oggetti distinti è pari al valore della lunghezza d'onda della luce che colpisce i nostri occhi. Di fatto, per tornare a vedere la figura di interferenza bisogna utilizzare lunghezze d'onda che non ci permettono di percepire gli elettroni come corpuscoli distinti.
Ma quindi l'elettrone cos'è? Un'onda o un corpuscolo? Con la franchezza e onestà intellettuale che lo contraddistinguevano, il grande fisico americano Richard Feynman rispondeva a questa domanda: "Non è nessuno dei due". Ciò sottolinea come l'idea di onda e corpuscolo siano concetti che appartengono alla fisica classica e che cerchiamo di far aderire ai fenomeni quantistici, mentre questi hanno un andamento assolutamente non inquadrabile secondo i nostri abituali schemi di ragionamento. L'elettrone è semplicemente un oggetto quantistico!
Ecco a confronto la distribuzione delle probabilità di onde, proiettili solidi ed elettroni:
Macrocosmo e indeterminazione
Per completare il discorso sulla dualità onda-corpuscolo, è necessario interrogarsi anche sulla validità di tale principio nel mondo macroscopico. Tale principio è valido anche nel macrocosmo. Se per esempio consideriamo l'esperimento della doppia fenditura per i proiettili, richiamando la formula di de Broglie precedentemente enunciata, abbiamo che il grande valore della massa in generale determina una frequenza molto alta, così alta che nella distribuzione della probabilità la figura di interferenza (tipica dei fenomeni ondulatori), seppur presente, è così fitta che non si distinguono i picchi, e la previsione della meccanica quantistica può essere approssimata dall'andamento effettivamente rappresentato nella seconda figura.
Infine, una considerazione fondamentale. Si è visto, nei precedenti esperimenti, come fosse grande la difficoltà di cogliere insieme entrambe le nature dell'elettrone, quella ondulatoria e quella corpuscolare. Cercando di determinare da quale fenditura passa l'elettrone, se ne distrugge la figura di interferenza, e per cercare di recuperarla si dovrebbero usare lunghezze d'onda che non rivelerebbero da quale fenditura l'elettrone è passato. Si potrebbe dire che, a seconda del punto di vista adottato, si possa rivelare solo uno degli innumerevoli aspetti di un fenomeno fisico, e la conoscenza di tale singolo aspetto preclude la possibilità, proprio per come è intrinsecamente organizzata la natura, di osservarne contemporaneamente un altro. Ciò proprio perché nel compiere un'osservazione, interferiamo con il sistema modificandolo e impedendogli di esprimersi in tutti i suoi possibili aspetti, ma solo in alcuni.
Questa intuizione, che aleggiava nell'animo di coloro che per primi lavorarono allo sviluppo della meccanica dei quanti, sarà poi lucidamente espressa dal fisico tedesco Werner Heisenberg con la formulazione del principio di indeterminazione.
La disposizione degli elettroni nell'atomo e il principio di esclusione di Pauli
Ci sembra opportuno accennare a uno dei principi fondamentali della meccanica quantistica, enunciato dal fisico austriaco Wolfgang Pauli nel 1925, che pur scaturendo dallo studio della struttura dell'atomo ha avuto importanti conseguenze soprattutto nel campo della Chimica.
Per prima cosa è necessario parlare dei numeri quantici, ossia una quaterna di valori (n, l, m e ms) che descrivono lo stato di un elettrone e che derivano dalla risoluzione dell'equazione di Schrödinger. Infatti ogni numero quantico indica un preciso parametro degli elettroni presenti intorno al nucleo sotto forma di orbitali:
il numero quantico principale n indica il livello di energia dell'elettrone e corrisponde sostanzialmente a una delle orbite stazionarie individuate da Bohr. Esso assume valori interi e positivi 1,2,3,4...
Il numero quantico secondario l indica i vari tipi di orbitale che ci possono essere in ogni livello energetico, e può assumere tutti i valori da 0 a n-1, a ognuno dei quali corrisponde un sottolivello di energia. Perciò ad ogni livello energetico corrisponde un numero di sottolivelli pari al numero quantico principale. Le lettere usate per indicare i primi quattro sottolivelli di ogni livello energetico sono s,p,d,f, ordinati per energia crescente all'interno del livello. Ad ogni sottolivello corrisponde una ben precisa forma dell'orbitale degli elettroni che ne fanno parte: sferico per s, a simmetria bilobata per gli orbitali p e a simmetria più complessa per gli altri orbitali. L'energia del singolo elettrone dipende approssimativamente dai due numeri quantici n e l.
Il numero quantico magnetico m indica il numero di orbitali che possono coesistere in un determinato sottolivello. Tali orbitali hanno tutti la stessa forma e stessa energia, ma sono diversamente orientati nello spazio, e la loro "fusione" dà vita all'orbitale specifico del sotto livello. Il numero di orbitali è da intendersi come il numero di orbitali "elementari" che fanno parte dell'orbitale dello specifico sottolivello energetico. Tali orbitali elementari contengono al massimo 2 elettroni. Quindi, il numero quantico magnetico, moltiplicato per 2, ci dà il numero massimo di elettroni presenti in quel dato sottolivello. Il valore di m dipende da quello di l, e può assumere 2l+1 valori diversi. Ad esempio, il sottolivello s ( che corrisponde a l=0, il primo sottolivello energetico) possiede un solo orbitale (2x(0)+1=1) che non ha nessun orientamento prevalente (in quanto a simmetria sferica) e corrisponde a m = 0. Quindi il sottolivello s contiene al massimo 2 elettroni. Per il sottolivello p ( l=1) sono ammessi 3 valori di m (2x(1)+1=3) che sono m=0, m=1 e m=-1, che indicano i tre orbitali p disposti lungo i tre assi x,y,z. Il numero massimo di elettroni contenuti nel sottolivello p è 6.
Per sapere il numero di elettroni contenuti in un preciso livello energetico, è sufficiente sommare il numero di elettroni contenuti nei vari sottolivelli che fanno parte del livello energetico. Ad esempio, nel livello energetico n=2, abbiamo l=1, ossia due sottolivelli, che sono il sottolivello s (l=0) e p (l=1). Il numero di orbitali possibili nel sottolivello s è uno solo, mentre nel sottolivello p sono tre. Moltiplicando entrambi i valori di m di entrambi i sottolivelli per due, e sommandoli tra di loro, si ha così che il numero massimo di elettroni nel secondo livello energetico è 8.
Il numero quantico di spin ms è, al contrario dei precedenti, una proprietà intrinseca dell'elettrone indipendentemente dagli altri numeri quantici e quindi da quale livello energetico, sottolivello o orbitale occupa, ma si riferisce alla proprietà generale degli elettroni, che oltre a ruotare intorno al nucleo presentano un'ideale rotazione attorno al proprio asse (il verbo inglese to spin significa appunto "ruotare"). Arbitrariamente sono stati assegnati come valori di spin degli elettroni +1/2 per una rotazione in senso orario, e -1/2 per una rotazione in senso antiorario.
Il principio di esclusione interviene proprio a questo punto, esso afferma che:
In un atomo non possono mai trovarsi due elettroni aventi la stessa quaterna di numeri quantici.
Ciò implicherebbe evidentemente una sovrapposizione di due elettroni identici. In particolare, considerando elettroni nello stesso orbitale (ossia con uguali valori di n, l, m) è necessario che il numero quantico di spin sia diverso, e considerato che i valori di spin sono solo due, si dimostra la conclusione già anticipata precedentemente secondo cui uno stesso orbitale può contenere solo due elettroni, che devono obbligatoriamente avere spin opposto.
Il Principio di Indeterminazione di Heisenberg
Una volta scoperte le interazioni tra radiazione e materia, si pone un nuovo problema: per misurare una quantità fisica è necessario vederla o renderla percepibile allo strumento di misura, ma per far ciò è indispensabile investirla con un qualche tipo di radiazione e ciò, come visto, ne altera la condizione, essendo la radiazione portatrice di energia. Secondo la visione moderna, conoscere significa misurare, ma misurare significa necessariamente modificare.
Ciò è particolarmente vero quando si parla di oggetti microscopici, per cui l'interazione con i fotoni energetici diventa particolarmente marcata e non può essere trascurata. Tale perturbazione si ripercuote anche sulla nostra possibilità di conoscere i parametri fisici che caratterizzano il sistema preso in considerazione. Da questa idea nacque il Principio di Indeterminazione, formulato nel 1927 da un ventiseienne Werner Heisenberg:
Ogni qualvolta vogliamo determinare simultaneamente la posizione x di un corpuscolo lungo una data direzione e la sua quantità di moto px lungo la stessa direzione, le incertezze ∆x e ∆px delle due grandezze sono legate dalla relazione:
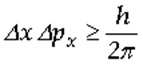
Similmente, se misuriamo l’energia E di un corpuscolo mentre esso si trova in un determinato stato, impiegando un intervallo di tempo ∆t per compiere tale osservazione, l’incertezza ∆E sul valore dell’energia è tale che:
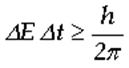
dove h rappresenta la costante di Plank e vale 6,62 ∙ 10-34 Js.
Questo principio esprime in forma matematica l'interrelazione tra quantità di moto e posizione e tra energia e tempo. Tali grandezze si dicono coniugate in quanto la precisione di una misura diminuisce mano a mano che compiamo una misurazione più precisa dell'altra grandezza coniugata. Questo perché il prodotto delle incertezze deve essere sempre maggiore o uguale ad un valore costante, riportato al secondo membro (indicato anche con ħ). Al limite, per un'incertezza nulla di una delle due grandezze coniugate, l'altra incertezza dovrà essere infinita.
Per via della coerenza della meccanica quantistica, le relazioni di Heisenberg sono valide per tutti i fenomeni naturali, e si possono quindi estendere anche al mondo macroscopico, anche se il piccolissimo valore della costante di Planck permette di considerare l'indeterminazione trascurabile rispetto agli errori sperimentali. Risulta utile sottolineare come la non eliminabilità dell'indeterminazione dei parametri che descrivono il sistema fisico non sia dovuta ad un'eventuale imprecisione dell'apparato sperimentale, a dei motivi tecnici, ma essa rappresenta una caratteristica fondamentale ed intrinseca della materia del microcosmo.
Una conseguenza fondamentale del Principio di Indeterminazione è l'introduzione del concetto di probabilità nella Fisica. In verità già prima della meccanica dei quanti si parlava di probabilità, nel campo della termodinamica e in particolare nella meccanica statistica. Ma in questi casi il ricorso alle probabilità era giustificato dallo studio di un grande numero di particelle, non analizzabili separatamente una ad una. Ma il Principio di Indeterminazione è ben più profondo: risulta possibile conoscere la condizione di una particella solo con un certo grado di imprecisione. Da questa conclusione, nascerà la nuova idea di orbitale elettronico, che sostituirà l'idea di orbita, che sostanzialmente è una regione dello spazio in cui è più probabile trovare un elettrone.
Tale visione probabilistica stride fortemente con quella che era la tradizione della Fisica classica, che fin dai tempi di Galileo e Newton si riconosceva come deterministica: secondo la visione classica bastava conoscere tutte le condizioni e tutte le forze agenti su di un sistema per poterne prevedere, attraverso la conoscenza delle leggi su cui si basano i fenomeni naturali, l'evoluzione nel futuro. Un'eventuale imprecisione nelle misurazioni era imputabile solo a un'inadeguatezza tecnica dell'apparato sperimentale. Comunque, tale "ottimismo" era dovuto proprio alla convinzione di poter conoscere la velocità e la posizione di tutte le componenti dell'universo. Ora, con questo nuovo principio, il probabilismo assumeva una connotazione primitiva, connaturata nella materia, generato da limiti fondamentali posti dalla natura alla nostra ricerca, e veniva intaccato il robusto legame tra cause (le condizioni iniziali) ed effetti (l'evoluzione del sistema fisico nel tempo)
La nuova visione del mondo influenzata dalla meccanica quantistica riguarda anche il concetto di "oggetto fisico" e "legge fisica". Sono da considerarsi proprietà del reale solo quelle entità che siano osservabili, ossia misurabili. Tale idea, a prima vista banale, esprime invece uno dei capisaldi della nuova Fisica, ossia il rifiuto di concetti "intuitivi" o "evidenti", come ad esempio i concetti di traiettoria o orbita, che per essere definiti richiedono però una conoscenza perfetta di posizione e velocità. Emerge il primato della Matematica e del suo formalismo nella descrizione delle dinamiche del mondo microscopico; ad esempio la prima ipotesi di antimateria deriva da un'equazione sullo stato dell'elettrone che accettava anche valori negativi. Per quanto riguarda la legge fisica, essa non è più concepita come la legge su cui si basa il funzionamento della natura, ma diventa un'astrazione concettuale che modellizza la realtà con un grado di imprecisione non eliminabile.
Tutto ciò significa che la fisica non è in grado di prevedere con assoluta certezza l'evoluzione di un sistema.
L'equazione di Schrödinger e la funzione d'onda
Tale equazione, che porta il nome del fisico austriaco che la formulò nel 1926, fu presentata dopo le ricerche di De Broglie sulla dualità onda-corpuscolo, e sta alla base della teoria ondulatoria della meccanica quantistica, un'interpretazione della meccanica quantistica alternativa e di pari valore rispetto alla meccanica delle matrici, sviluppata negli stessi anni dalla scuola di Copenhagen (in cui svolgevano i loro studi scienziati come Heisenberg, Bohr e Pauli). Al di là dell'equazione in sé e del suo metodo di risoluzione, ciò che interessa qui è mostrare alcune delle sue conseguenze.
Innanzitutto questa equazione serve a fornire lo stato di un sistema quantistico, ossia la sua risoluzione permette di trovare una funzione (in quanto l'equazione di Schrödinger è un'equazione differenziale alle derivate parziali), chiamata funzione d'onda ψ, che descrive lo stato di un oggetto quantistico. Infatti tale funzione, a valori complessi e dipendenti da variabili temporali e spaziali, contiene tutte le informazioni riguardo l'evoluzione nello spazio e nel tempo di un'onda-particella quantistica entro un campo di forza conservativo. Ovviamente quando si parla di spazio si considera una distribuzione nello spazio, in quanto l'oggetto quantistico non ha solo natura corpuscolare ma anche ondulatoria, e quindi non è possibile parlare di posizione precisa nello spazio. Viene definita funzione d'onda in quanto descrive l'andamento di un corpuscolo materiale considerandolo come un'onda.
La probabilità di trovare all'istante t e nella posizione (x,y,z), dove le tre lettere indicano le tre dimensioni dello spazio, la particella "sparpagliata" in una regione di volume ΔV è data da:
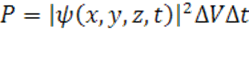
Risulta necessario specificare come sulla natura della funzione d'onda ancora oggi ci sia un certo disaccordo nella comunità scientifica. Visioni divergenti si ebbero già ai tempi della sua formulazione, quando si contrapponevano due diverse scuole di pensiero: una, la scuola realista, che faceva capo a Schrödinger, considerava la funzione d'onda come la descrizione di una vera e propria onda materiale, in modo che ogni elettrone fosse "sparpagliato" in un'onda, e il suo movimento corrispondesse al propagarsi nello spazio di un fronte d'onda sferico. Ciò spiegava magnificamente le figure di interferenza negli esperimenti con la doppia fenditura. Gli stessi esperimenti rivelavano però che, viste da vicino le lastre dei rilevatori, si potevano distinguere i singoli punti di contatto tra elettroni e rilevatori. Nel momento in cui veniva rilevato, era come se l'elettrone cambiasse natura, da ondulatoria a corpuscolare. Si può immaginare che l'onda, venuta a contatto con il rilevatore in un punto x, collassi tutta in quel punto, dove effettivamente verrà rilevato l'elettrone, mentre l'onda sparisce istantaneamente in tutti gli altri punti dello spazio. Tale enigmatico fenomeno venne definito come collasso della funzione d'onda.
La soluzione standard, anticipata sopra, per interpretare il collasso della funzione d'onda fu fornita dai fisici delle scuole di Gottinga e Copenhagen, i quali rappresentavano la seconda scuola di pensiero, mediante l'interpretazione probabilistica di Born e Bohr. La funzione d'onda non descrive un'onda materiale, è priva di significato fisico, ma è piuttosto una costruzione matematica, la quale esprime la probabilità di trovare un oggetto quantistico in un determinato luogo. Considerata come "onda di probabilità", il collasso della funzione d'onda si ha ogniqualvolta effettuiamo una misurazione sul sistema: infatti nel momento in cui individuiamo un oggetto in un punto x, la probabilità di trovarlo in quel luogo diventa del 100%, mentre si annulla in tutti gli altri punti dello spazio. Così si supera il problema che deriva dall'interpretare la funzione d'onda come l'andamento di un'onda materiale: come si può infatti spiegare l'annullamento istantaneo dell'onda materiale in un punto diverso da quello in cui viene rilevato l'elettrone? Secondo tale interpretazione, la funzione d'onda non è quindi un'onda reale che si propaga nello spazio fisico, ma un oggetto matematico che si propaga in uno spazio matematico astratto, lo spazio delle configurazioni.
L'equazione di Schrödinger, oltre ad essere una delle più importanti della meccanica quantistica, è stata fondamentale anche per pervenire ad una conoscenza più approfondita dell'atomo. Infatti grazie ai contributi della nuova equazione fu possibile elaborare un nuovo modello atomico, successivo a quello di Bohr, il modello della meccanica ondulatoria. In esso si adotta un'interpretazione fisica della funzione d'onda, che rivolta allo studio dello stato degli elettroni, ne giunge a definire lo stato energetico (peraltro in accordo con gli stati energetici indicati da Bohr). Grazie a questa interpretazione fisica dei risultati dell'equazione, l'idea di funzione d'onda come onda di probabilità genera il concetto di orbitale, ossia di una zona attorno al nucleo in cui le probabilità di trovare l'elettrone sono molto alte. Grazie all'idea di orbitale, più avanzata e sottile rispetto a quella delle orbite di Bohr, si è potuto pervenire a una visualizzazione più completa ed efficace dell'atomo.
Fonte: http://nuke.vprof.it/LinkClick.aspx?fileticket=CjGCQkRsdJc%3D&tabid=56&mid=455
Sito web da visitare: http://nuke.vprof.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve