

I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Agli inizi dell’800 erano già stati identificati una cinquantina di elementi chimici che il chimico svedese J.J. Berzelius (1779 – 1848) raccolse nel 1818 in una tabella. Lo stesso Berzelius propose di adottare la simbologia chimica attualmente in uso.
Ciascun elemento chimico viene univocamente associato ad un simbolo, in genere corrispondente all’iniziale del suo nome latino (o alle prime due lettere se vi è possibilità di equivoco con altri elementi). Ad esempio C è il Carbonio, Ca il Calcio, Ce il Cerio, Co il Cobalto, Cu il Rame.
I simboli rappresentano sia gli elementi che i relativi atomi. Così N rappresenta l’elemento Azoto, ma anche un atomo di Azoto. In questo modo è possibile rappresentare le sostanze chimiche mediante opportune scritture convenzionali, dette formule.
Nelle formule sono rappresentati i simboli degli elementi chimici che costituiscono la sostanza, ciascuno seguito in basso a destra da un numero, detto indice, che specifica quanti atomi di quell’elemento sono presenti. L’indice 1 non compare, essendo sottinteso.
H2SO4 CO2 H2O N2 Na2CO3 O2 Mg(NO3)2
Come si può osservare dalle formule che le rappresentano, le sostanze chimiche possono essere costituite da atomi di uno stesso elemento (O2 N2) e sono perciò dette sostanze elementari, o da atomi di elementi diversi (H2SO4 CO2) e sono perciò dette sostanze composte o, semplicemente, composti.
I composti sono sostanzialmente di due tipi: molecolari o ionici.
Un composto molecolare è formato da molecole. Una molecola è la più piccola parte di materia che presenta le medesime caratteristiche chimiche della sostanza alla quale appartiene. È costituita da un gruppo definito di atomi, tra loro legati, ma distinti e separati dagli atomi che costituiscono altre molecole. Le formule che rappresentano tali composti sono dette formule molecolari.
Un composto ionico è costituito dall’alternarsi di anioni e cationi legati dalla reciproca attrazione elettrostatica e presenti in rapporti precisi, definiti dalla loro carica. Ad esempio nel carbonato di sodio si alternano ioni Na+ e ioni CO32- nel rapporto di 2:1, necessario per neutralizzare le cariche elettriche. La formula Na2CO3 non rappresenta la molecola, che non esiste in quanto tale, ma descrive il minimo rapporto di combinazione tra gli elementi. Tali formule sono dette formule minime.
Gli ioni presentano, ad esponente del simbolo che li rappresenta, il numero di cariche, positive o negative che li caratterizza, esattamente pari al numero di elettroni persi o acquistati.
Esistono anche ioni poliatomici.
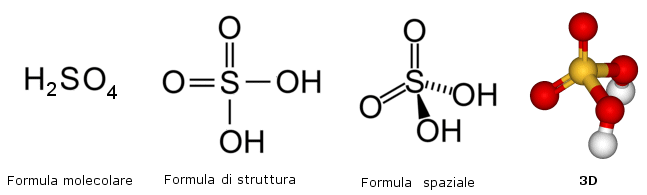
Tali formule (sia molecolari che minime) non danno alcuna informazione sulla disposizione spaziale degli atomi e dei loro legami. A questo scopo sono state introdotte rappresentazioni, dette formule di struttura. In relazione al grado di dettaglio e di accuratezza desiderato le formule di struttura possono eventualmente riportare, oltre alla posizione dei legami, anche la loro orientazione nello spazio (angolo di legame) e quindi dare informazioni sulla struttura tridimensionale (geometria) della sostanza.
Nelle trasformazioni chimiche, comunemente dette reazioni chimiche, le sostanze messe a reagire, dette reagenti, si trasformano in altre specie chimiche, dette prodotti di reazione. Ciò avviene essenzialmente perché alcuni legami che tenevano uniti gli atomi nelle sostanze reagenti si spezzano e si riformano secondo nuove combinazioni. Le nuove configurazioni atomiche che si generano costituiscono i prodotti finali della reazione.
Ovviamente durante tali trasformazioni il numero totale di atomi di ciascun elemento chimico non varia, anche se si trova diversamente combinato nei prodotti rispetto ai reagenti (principio della conservazione della materia).
Una reazione chimica viene simbolicamente rappresentata mediante un’equazione chimica. A primo membro troviamo le formule dei reagenti, mentre a secondo membro le formule dei prodotti di reazione, tutte separate dal segno di addizione (+). Il segno di eguaglianza tra i due membri (=) viene sostituito dalla freccia di reazione (®), se la reazione si completa e tutti i reagenti si trasformano nei prodotti o dalla doppia freccia di reazione (![]() ), se si tratta di un equilibrio chimico e la reazione forma una miscela in equilibrio di reagenti e prodotti.
), se si tratta di un equilibrio chimico e la reazione forma una miscela in equilibrio di reagenti e prodotti.
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve