I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Titolo:
Acido forte, Base forte
Obiettivo:
Costruire la curva di titolazione per una reazione acido forte (HCl) – base forte (NaOH)
Materiali ed apparecchiature utilizzate:
Descrizione esperienza:
La prima operazione svolta è stata l’avvinamento, abbiamo messo all’interno della buretta una piccola parte di soluzione e l’abbiamo fatta ruotare per eliminare residui d’acqua e altre sostanze posizionati sulle pareti dello strumento.
Abbiamo riempito la buretta da 25ml di HCl.
Abbiamo acceso il pHmetro e abbiamo posizionato la sua sonda nel becher contenente 20ml di NaOH (0,1N), l’indicatore fenolftaleina, unito ad un po’ di H2O.
Abbiamo posizionato il becher, in cui all’interno c’era un agitatore magnetico, sul fornello e questo grazie al campo magnetico faceva agitare la soluzione così da far combinare più velocemente le due sostanze.
Abbiamo iniziato a far scendere il titolante (HCl) all’interno del titolato.
Questa operazione è stata eseguita lentamente facendo scendere dalla buretta 1ml di titolante a volta.
Ad ogni aggiunta di HCl siamo andati a leggere il valore di pH misurato dallo strumento.
Ai primi 5ml di volume di HCl aggiunto il pHmetro non è funzionato correttamente e quindi le abbiamo eliminate e non ne abbiamo tenuto conto, dai 6ml abbiamo iniziato a trascrivere i valori di pH.
Quando ci siamo avvicinati al punto di viraggio precisamente a 18,5ml di volume aggiunto, abbiamo iniziato a far scendere il titolante nel becher di un decimo di ml, questo per riuscire a calcolare il valore di pH al viraggio precisamente.
Alla misura di 18,8ml, di volume aggiunto di HCl, ed un pH di 8,45 abbiamo notato il viraggio di colore, grazie all’indicatore da rosa a trasparente.
Il pH neutro l’abbiamo rilevato ad una misura di 19,3ml di volume aggiunto.
Poi, quando l’Acido Cloridrico è finito nella buretta ne abbiamo rimesso un po’ in più per il tratto constante della curva.
Reazione:
La reazione di neutralizzazione che avviene fra le due sostanze è la seguente
Tabelle e Grafici:
VHCl (ml)Aggiunto |
pH |
0 |
12,3 |
6 |
12,1 |
7 |
12,07 |
8 |
12,03 |
9 |
11,97 |
10 |
11,92 |
11 |
11,87 |
12 |
11,8 |
13 |
11,72 |
14 |
11,63 |
15 |
11,5 |
16 |
11,33 |
17 |
11,07 |
17,5 |
10,85 |
18 |
10,44 |
18,5 |
9,85 |
18,6 |
9,65 |
18,7 |
9,25 |
18,8 |
8,45 |
18,9 |
7,95 |
19 |
7,73 |
19,1 |
7,59 |
19,2 |
7,35 |
19,3 |
7 |
19,4 |
5,45 |
19,5 |
4,20 |
19,6 |
3,90 |
19,7 |
3,75 |
19,8 |
3,63 |
19,9 |
3,54 |
20 |
3,47 |
20,1 |
3,40 |
20,2 |
3,34 |
20,3 |
3,29 |
20,4 |
3,25 |
20,5 |
3,22 |
20,6 |
3,18 |
20,7 |
3,15 |
20,8 |
3,13 |
20,9 |
3,10 |
21 |
3,07 |
22 |
2,86 |
23 |
2,75 |
24 |
2,66 |
25 |
2,59 |
26 |
2,53 |
27 |
2,48 |
28 |
2,44 |
29 |
2,40 |
30 |
2,37 |
31 |
2,34 |
32 |
2,31 |
33 |
2,29 |
34 |
2,26 |
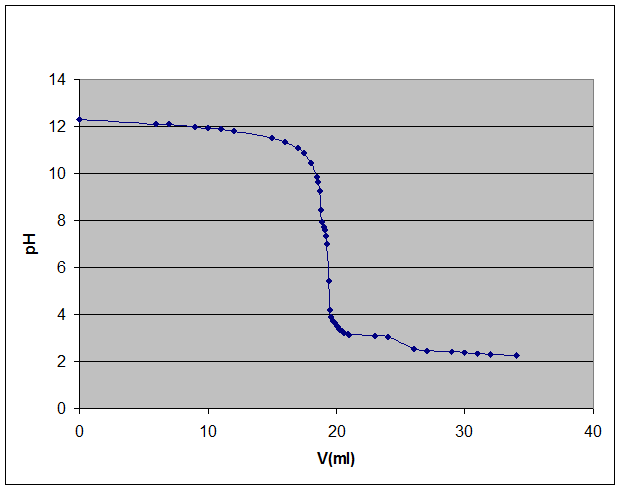
Grafico sperimentale:
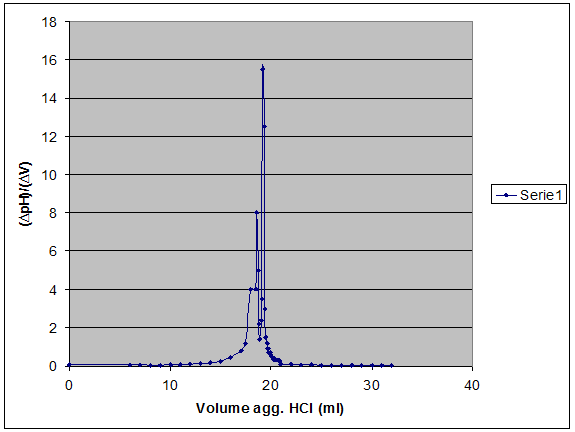
1° Derivata
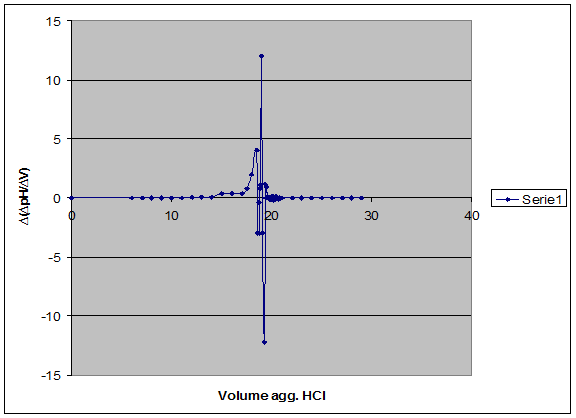
2°Derivata
Calcolo teorico:
M = moli / V
n°moliNaOH = MNaOH * VNaOH = 0,1* 0,02L = 2*10-3moli
Prima del punto di equilibrio:
[OH-]= (moliNaOHiniziali - moliHCl agg) / (Viniz + Vagg)
1) V agg = 1ml
n°moli HCl agg = M HCl * V HCl = 0,1 * 0,001L = 1*10-4moli
[OH-]= (moliNaOHiniziali - moliHCl agg) / (Viniz + Vagg)
[OH-]= (2*10-3moli -1*10-4moli) / (0,02 + 0,001) = 1,9*10-3/0,021= 0,09moli/litro
pOH = -log[OH-]= -log 0,09= 1,04
pH= 14 – 1,04= 12,96
2) V agg = 6ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,006L = 6*10-4 moli
[OH-]= (moliNaOHiniziali - moliHCl agg) / (Viniz + Vagg)
[OH-]= (2*10-3moli -6*10-4moli) / (0,02 + 0,006) = 0,054 moli/litro
pOH = -log[OH-]= -log 0,054= 1,27
pH= 14 – 1,27= 12,73
3) V agg = 12ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,012L =1,2*10-3 moli
[OH-]= (moliNaOHiniziali - moliHCl agg) / (Viniz + Vagg)
[OH-]= (2*10-3moli -1,2*10-3moli) / (0,02 + 0,012) =0,0025 moli/litro
pOH = -log[OH-]= -log 0,0025= 1,6
pH= 14 – 1,6= 12,4
4)V agg = 18,7ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,0187L =1,87*10-3 moli
[OH-]= (moliNaOHiniziali - moliHCl agg) / (Viniz + Vagg)
[OH-]= (2*10-3moli -1,87*10-3moli) / (0,02 + 0,0187) = 3,36 *10-3 moli/litro
pOH = -log[OH-]= -log3,36 *10-3 = 2,47
pH= 14 – 1,04= 11,53
5)V agg = 18,9ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,0189L =1,89*10-3 moli
[OH-]= (moliNaOHiniziali - moliHCl agg) / (Viniz + Vagg)
[OH-]= (2*10-3moli -1,89*10-3moli) / (0,02 + 0,0189) = 2,83*10-3 moli/litro
pOH = -log[OH-]= -log3,36 *10-3 = 2,55
pH = 14 – 2,55 = 11,45
6)V agg = 19,2ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,0192L =1,92*10-3 moli
[OH-]= (moliNaOHiniziali - moliHCl agg) / (Viniz + Vagg)
[OH-]= (2*10-3moli -1,92*10-3moli) / (0,02 + 0,0192) = 2,04*10-3 moli/litro
pOH = -log[OH-]= -log 2,04 *10-3 = 2,69
pH = 14 – 2,69 = 11,3
Dopo punto di equivalenza:
[H30+]= (moliHCl - moliNaOH) / (Viniz+Vagg)
7)V agg = 20,1ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,0201L =2,01*10-3 moli
[H30+]= (moliHCl agg- moliNaOH iniz) / (Viniz+Vagg)
[H30+]= (2,01*10-3 – 2*10-3) / (0,02 + 0,021 ) = 2,49 * 10-4 moli/litro
pH = - log [H+]= - log 2,49 * 10-4 = 3,6
8)V agg = 20,5ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,0205L =2,05*10-3 moli
[H30+]= (moliHCl agg- moliNaOH iniz) / (Viniz+Vagg)
[H30+]= (2,05*10-3 – 2*10-3) / (0,02 + 0,0205 ) = 1,23 * 10-3 moli/litro
pH = - log [H+]= - log 1,23 * 10-3 = 2,91
9)V agg = 21ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,021L =2,1*10-3 moli
[H30+]= (moliHCl agg- moliNaOH iniz) / (Viniz+Vagg)
[H30+]= (2,1*10-3 – 2*10-3) / (0,02 + 0,021 ) = 2,44 * 10-3 moli/litro
pH = - log [H+]= - log 2,44 * 10-3 = 2,61
10)V agg = 27ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,0195L =2,7*10-3 moli
[H30+]= (moliHCl agg- moliNaOH iniz) / (Viniz+Vagg)
[H30+]= (2,7*10-3 – 2*10-3) / (0,02 + 0,027 ) = 0,015 moli/litro
pH = - log [H+]= - log 0,015 = 1,8
11)V agg = 34ml
n°moli HClagg = M HCl * V HCl = 0,1* 0,034L =3,4*10-3 moli
[H30+]= (moliHCl agg- moliNaOH iniz) / (Viniz+Vagg)
[H30+]= (3,4*10-3 – 2*10-3) / (0,02 + 0,034) = 0,025 moli/litro
pH = - log [H+]= - log 0,025 = 1,5
Grafico sperimentale:

Confronto tra grafico sperimentale e grafico teorico
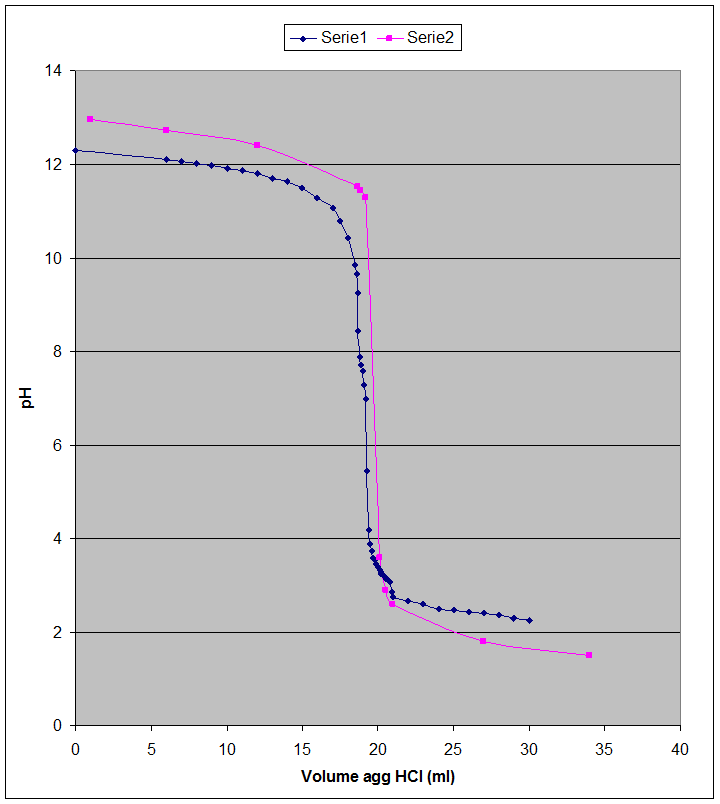
Conclusioni
In questa esperienza abbiamo svolto la titolazione fra un acido forte e una base forte, con lo scopo di determinare la curva di titolazione, ovvero il grafico che rappresenta la variazione del pH della soluzione acida all’aggiunta di ioni OH- .
Essa è un metodo chimico usato per determinare la concentrazione di un soluto in una soluzione. Tale scopo si raggiunge aggiungendo alla soluzione di concentrazione incognita una soluzione di composizione nota in modo da determinare una reazione chimica che proceda rapidamente nel nostro caso di neutralizzazione.
La soluzione reattiva viene aggiunta goccia a goccia utilizzando la buretta, in modo che al termine della reazione sia immediato misurare il volume di reattivo aggiunto; da questa misura si risale alla concentrazione di soluto nella soluzione.
Nel nostro caso il viraggio è avvenuto ad un valore di pH di 8,45 e non a 7 perché abbiamo usato l’indicatore fenolftaleina che vira di colore in un intervallo di unità che và da 8,2 a 10, sarebbe stato meglio utilizzare l’indicatore blu di bromotimolo che vira in un intervallo che va dà 6 a 7,6 per visualizzare meglio il punto di equivalenza.
Intorno al punto di equivalenza (p.e.) si verifica una notevole variazione del pH ( salto di pH ) in quanto, vicino alla neutralità, ove si ha
[OH -] = [H3O+] = 1 · 10-7 M, anche un piccolo eccesso di base o di acido provoca notevoli variazioni della concentrazione degli stessi ioni e, di conseguenza, del pH.
L'eccesso di base o di acido ha, ovviamente, effetti tanto meno evidenti sul pH quanto maggiore è il valore di [OH -] o di [H3O+] che si trovano in soluzione
Possiamo, inoltre notare dal 1° grafico che i punti iniziali e i punti finali della curva si trovano in una zona a debole pendenza, in cui la variazione del pH è scarsa, di conseguenza la concentrazione dell’acido forte e della base forte sono circa uguali e quindi assumono una caratteristica di soluzioni tampone: una soluzione in grado di opporsi a variazioni del pH conseguenti all’aggiunta di limitate quantità di acidi e basi forti
Molte volte nelle nostre esperienze le soluzioni tampone vengono utilizzate come standard per la misurazione del pH.
Fonte: http://lnx.itislanciano.it/joom/files/MATERIALI%20DIDATTICI/Chimica/titol_%20ac%20for_%20base%20for.doc
Sito web da visitare: http://lnx.itislanciano.it/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve