I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
VARIAZIONE DELL’ENERGIA INTERNA IN UNA TRASFORMAZIONE A PRESSIONE COSTANTE (P = cost.)
Un cilindro contiene 2 g di elio (gas monoatomico) alla pressione P1 = 5´105 Pa. Il volume occupato dal gas è di 2 litri.
Mantenendo costante la pressione, il gas subisce una espansione termica dopo che è stato messo a contatto con una sorgente di calore. Il volume finale del gas è di 8 litri.
Calcolare il calore scambiato, lavoro compiuto dal gas e la variazione di energia interna.
Massa dell’elio: m = 2 g;
Massa atomica dell’elio: M = 4 g.mol-1
Pressione del gas negli stati iniziale e finale: P1 = P2 = 5´105 Pa
Volume iniziale del gas: Vi = V1 = 2 l = 2´10-3 m3
Volume finale del gas: Vf = V2 = 8 l = 8´10-3 m3
Costante dei gas perfetti: ![]()
Numero delle moli: Prima di tutto si calcola il numero delle moli, n. ![]() .
.
Temperatura iniziale: La temperatura iniziale si calcola adoperando l’equazione di stato dei gas perfetti di P. Clapeyron. Dalla P×V = n×R×T si ha:
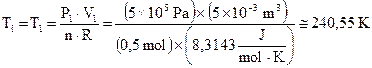
Pertanto la temperatura del gas prima che inizi la trasformazione è: T1 = 240,55 K.
Temperatura finale: Dalla legge di Charles – Volta – Gay-Lussac si ricava il valore della temperatura finale T2:
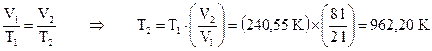
La temperatura finale è T2 = 962,20 K.
Calore scambiato: Il calore scambiato nella trasformazione a pressione costante è:
E = n×cP×(T2 – T1)
dove:
n è il numero delle moli;
cP è il calore specifico molare (cioè riferito ad una mole di gas) a pressione costante.
Per un gas monoatomico, come l’elio, il calore specifico a pressione costante è:
![]()
Sostituendo i valori di n e di cP si ha:
E = n×cP×(T2 – T1) = ![]()
Il valore del calore scambiato è positivo, quindi esso è stato assorbito dal gas durante la trasformazione termodinamica.
Lavoro compiuto: Prima che iniziasse la trasformazione isobara, il pistone si trova ad un’altezza h1 dal fondo del cilindro. Alla fine della trasformazione il pistone si trova ad una altezza h2. Pertanto il pistone ha subito uno spostamento pari a:
Ds = h2 – h1
Sul pistone agisce una forza dovuta agli urti degli atomi di elio contro il pistone. Durante la trasformazione agisce una forza ![]() per uno spostamento
per uno spostamento ![]() , pertanto viene compiuto un lavoro L pari a:
, pertanto viene compiuto un lavoro L pari a:
L = ![]() ×
×![]() = F×(h2 – h1)
= F×(h2 – h1)
Indicando con A la superficie del pistone e tenendo presente la definizione di pressione ![]() si ha che
si ha che
F = P×A
Sostituendo tale quantità nell’espressione del lavoro, si ha:
L = F×(h2 – h1) = P×A××(h2 – h1) = P×[A×h2 – A×h1]
La quantità A×h2 è il volume finale del gas:
V2 = A×h2
mentre A×h1 è il volume iniziale
V1 = A×h1
Pertanto il lavoro compiuto dal gas nell’andare dalla stato 1 allo stato 2 è
L1®2 = P×(V1 – V2) = P×DV
Introducendo i valori si ha:
L1®2 = (5´105 Pa)´[(8´10-3 m3) – (2´10-3 m3)] = (5´105 Pa)´(6´10-3 m3) = + 3.000 J
Il valore del lavoro è positivo (espansione el gas), per cui il lavoro è compiuto dal gas sull’ambiente circostante
L1®2 = + 3.000 J
La parte tratteggiata sotto la curva rappresenta il lavoro compiuto.
Variazione dell’energia interna: Applicando il primo principio della termodinamica si può ricavare la variazione di energia interna subita dal gas:
DU = E – L = (+ 7.500 J) – (+ 3.000 J) = + 4.500 J
La variazione di energia interna è positiva. Poiché l’energia interna è una grandezza collegata alla temperatura del gas, il risultato (l’energia interna è aumentata) è concorde con il fatto che durante la trasformazione la temperatura aumenta.
Se il gas fosse stato biatomico, il calore specifico a pressione costante sarebbe:
![]()
Fonte: http://www.liceolanzafoggia.it/index.php/filemanager/download/932/
Sito web da visitare: http://www.liceolanzafoggia.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve