I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
TERMOCHIMICA : I PRINCIPIO e ENTALPIA
La Termodinamica studia le proprietà macroscopiche della materia senza entrare nel merito della struttura molecolare. Spiega se una trasformazione può o non può avvenire fino a raggiungere uno stato di equilibrio. Non ci dice nulla sul tempo necessario. Infatti per ogni reazione dobbiamo sapere:
ALCUNE DEFINIZIONI
SISTEMA E AMBIENTE:
si definisce “sistema” una porzione di materia delimitata da confini e/o superfici reali o immaginarie e che è oggetto del nostro studio; si definisce “ambiente” tutto ciò che si trova al di fuori del sistema ma interagisce con esso. L’insieme di sistema+ambiente si chiama UNIVERSO.
Il SISTEMA TERMODINAMICO è un sistema che può essere descritto mediante grandezze fisiche ( temperatura, pressione : grandezze INTENSIVE) e grandezze o variabili chimiche ( es. numero di moli : grandezza ESTENSIVA).
I sistemi si possono classificare in:
Un sistema viene descritto da grandezze fisiche che dipendono solo dallo stato iniziale e finale e non dal percorso effettuato per far avvenire la trasformazione: queste grandezze sono dette FUNZIONI DI STATO (es. temperatura, volume, pressione)
ENERGIA : capacità di un corpo di compiere un lavoro o quantità di calore posseduta da un corpo
Unità di misura JOULE = N x m = Kg x m2/ s2 cal = 4,184 J
CALORIA : quantità di calore necessaria per innalzare la temperatura di 1 grammo di acqua da 14,5 °C a 15,5 °C
L’ energia si può presentare sotto diverse forme:
ENERGIA CINETICA associata al movimento di un corpo E = ½ m v2
ENERGIA POTENZIALE associata alla posizione di un corpo E = mgh
LAVORO : viene associato allo sforzo compiuto da una macchina o da un essere vivente per spostare un oggetto. Infatti il lavoro meccanico è dato da:
L = F x s ( forza x spostamento)
Nel caso in cui il lavoro è associato ad una variazione di volume ( fatto piuttosto frequente nelle reazioni chimiche) allora :
L = P x DV
Il lavoro non è funzione di stato; infatti dipende da come viene effettuata la trasformazione
Il lavoro è un modo di trasferire energia dal sistema all’ambiente e viceversa
Secondo la “convenzione egoistica”
L > 0 lavoro compiuto dal sistema
L < 0 lavoro subito dal sistema
CALORE
E’ un altro modo per trasferire energia ed è considerata una forma disordinata di energia; il trasferimento di calore si ha quando esiste una differenza di temperatura ( dal corpo caldo al corpo più freddo). In analogia con il lavoro anche il calore non è funzione di stato.
Il calore è una forma di energia che può essere misurata con il calorimetro e in base alla relazione:
Cp = q / DT e Cp = m cs
Cioè il calore q si ricava dalla capacità termica Cp e dalla differenza di temperatura misurata
Secondo la “convenzione egoistica”
Q > 0 calore assorbito dal sistema
Q < 0 calore ceduto dal sistema
PRIMO PRINCIPIO DELLA TERMODINAMICA
I sistemi chimici si comportano spesso da sistemi aperti o al massimo chiusi.
Per es. la decomposizione di un pezzo di carbonato di calcio per riscaldamento porta allo scambio sia di calore che di materia (cioè sviluppo di un gas come la CO2) ; è quindi un sistema aperto.
Un altro esempio è la cellula che scambia continuamente energia e materia con l’ambiente. Un’altra reazione, come lo zinco con solfato di rame che produce solfato di zinco e rame metallico, provoca solo scambio di energia sottoforma di calore (sistema chiuso).
Invece in un sistema isolato non ci sono scambi.
Il PRIMO PRINCIPIO della TERMODINAMICA o principio di conservazione dell’energia afferma che in un SISTEMA ISOLATO l’energia si mantiene costante anche se può convertirsi da una forma all’altra.
Qualunque trasformazione da uno stato ad un altro che comporti scambi di calore e lavoro è sempre accompagnata dalla variazione di ENERGIA INTERNA U o E che è la somma di tutti i contributi di energia cinetica e energia potenziale delle particelle; queste grandezze non sono determinabili singolarmente quindi possiamo conoscere solo la variazione di energia interna di un sistema.
E = Enuc + Etrasl + Erot + Evib + Eel
Per esempio se fornisco calore al sistema, questo comporta una variazione di energia interna ma può anche tradursi in lavoro che il sistema può compiere; allora per il primo principio la variazione di energia interna che subisce un sistema è calcolata mediante il bilancio energetico tra il calore scambiato e il lavoro compiuto
ovvero DU = q – w ( espressione più nota del I principio)
“ In un sistema isolato l’energia si mantiene costante anche se può convertirsi da una forma ad un’altra”
Spesso il lavoro compiuto dal sistema è associato ad una variazione di volume
Un gas che si espande per riscaldamento fa muovere il pistone e per fare ciò compie un lavoro
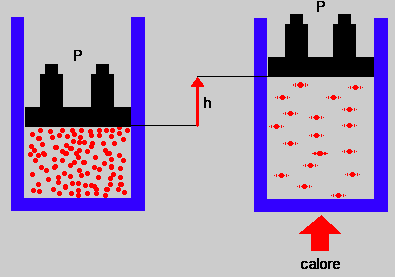
Il lavoro viene calcolato come w = PDV
allora DU = q – P DV
Consideriamo per semplificare due tipi di trasformazione
DV = 0 ( per es. se faccio avvenire una reazione in un recipiente chiuso e rigido )
allora DU = q – 0 = qv
cioè la variazione di energia Interna coincide con il calore scambiato.
Le reazioni generalmente avvengono a pressione costante (es. recipiente aperto o con pistone mobile) e se c’è espansione di un gas ci sarà un lavoro di volume.
Occorre definire una nuova funzione di stato che tenga conto anche del lavoro di volume che il sistema compie o subisce durante una trasformazione a recipiente aperto : ENTALPIA H
H = U + PV
DH = DU + P DV + VDP = q – P DV + P DV = qp
cioè la variazione di entalpia equivale al calore scambiato a pressione costante quando il lavoro è solo di volume. E ed H sono diverse solo per i gas perché nei liquidi e nei solidi le variazioni di volume sono trascurabili.
Se q<0 DH <0 reazione esotermica
Se il calore viene liberato significa che l’energia dei prodotti è minore di quella dei reagenti cioè in termini di energia di legame avremo dei legami più forti nei prodotti
Se q >0 DH> 0 reazione endotermica
Se il calore viene assorbito significa che l’energia dei prodotti è maggiore di quella dei reagenti cioè in termini di energia di legame avremo dei legami più forti nei reagenti.
Non è possibile conoscere il valore di H dei singoli reagenti o prodotti ma solo la variazione riferita ad una certa reazione.
Le trasformazioni a pressione costante rivestono una grande importanza anche in campo biologico: infatti il calore scambiato nei processi vitali coincide con la variazione del contenuto entalpico della cellula.
Si definisce CALORE STANDARD DI FORMAZIONE (DH°f) la quantità di calore ceduto o assorbito quando una mole di composto si forma dagli elementi nel loro stato standard che reagiscono in quantità stechiometriche.
Le condizioni standard sono:
T = 25 ° C P = 1 atm soluzioni 1 molari
Si definisce calore standard di reazione:
DH°reaz = SDH°f (prod) - SDH°f (reag)
Secondo la legge di HESS o di “additività dei calori di reazione”, poiché l’entalpia è una funzione di stato, posso ottenere la stessa variazione nel sistema seguendo percorsi diversi. Ciò significa che se due reazioni (1 e 2) comportano una variazione di entalpia DH1 e DH2, un’eventuale reazione 3 che corrispondesse alla somma di 1 e 2 avrebbe
DH3 = DH1 + DH2
E’ utile perché permette di ricavare in maniera indiretta i calori di reazioni difficile da ottenere sperimentalmente.
Fonte: http://chimicaelab.altervista.org/download/tecnico_sanitario_chimica/ENTALPIA.doc
Sito web da visitare: http://chimicaelab.altervista.org
Autore del testo: indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve