I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
TEORIA CINETICA DEI GAS
Il matematico e fisico svizzero Daniel Bernoulli (1700-1782), nel 1738 sviluppando la concezione atomistica di scienziati come Pierre Gassendi (1592-1655), Isacco Newton (1642-1727) e Ruggero Giuseppe Boscovich (1711-1787), avanzò l’idea che i gas sono formati da corpuscoli elastici che interagiscono mediante urti, secondo le leggi della meccanica elementare. In base a questa concezione fornì una spiegazione della pressione esercitata dai gas sulle pareti. L’idea non ebbe uno sviluppo che meritava.
La teoria fu ripresa successivamente da John Herapath (1790-1868), John James Waterston (1811-1883), August Karl Kroenig (1822-1879), James Prescott Joule (1818-1889).
Il fisico tedesco Rudolf Clausius (1822-1888) nel 1847 propose il modello di gas perfetto supponendo che
In sintesi:
Con questo modello di gas perfetto ed applicando le leggi della meccanica alle molecole si troverà una relazione tra grandezze microscopiche e quelle macroscopiche.
Lo sviluppo moderno della teoria cinetica si ebbe con James Clerk Maxwell (1831-1879), Ludwig Boltzmann (1844-1906) e Josiah Willard Gibbs (1839-1903), i quali diedero le fondamenta a ciò che oggi viene chiamata fisica statistica.
Si considera un gas all’interno di un recipiente di forma cubica. Il gas è composto di N particelle tutte uguali. La grandezza da calcolare è la pressione esercitata dal gas sulle pareti del recipiente che lo contiene.
Per semplificare il modello, si considera una sola particella, di massa m, che si muove lungo l’asse x, perpendicolare a due pareti, 1 e 2.
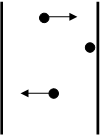
La particella si muove verso sinistra con velocità vx. Incontra la parete 1, subisce un urto elastico con la parete, rimbalza all’indietro con velocità uguale ed opposta, -vx, a quella che essa aveva prima dell’urto. Prima dell’urto la particella valeva una quantità di moto pari a:
qx, iniziale = m×vx
Dopo l’urto la particella ha una quantità di moto pari a
qx, finale = -m×vx
In seguito all’urto la particella ha subito una variazione di quantità di moto pari a:
Dqparticella = qx, finale - qx, iniziale = -m×vx - (m×vx) =
= -m×vx - m×vx = -2 m×vx
Il principio della quantità di moto afferma che in un sistema chiuso la quantità di moto si deve conservare. In questo modello il sistema è costituito dalla particella e dalla parete. Pertanto la quantità del sistema, particella + parete, prima dell’urto deve essere uguale a quella dopo l’urto:
qx, iniziale particella = qx,finale particella + qparete
La variazione di quantità di moto subita dalla particella è uguale e contraria a quella subita dalla parete:
Dqparete = -Dqparticella
quindi:
Dqparete = -(-2×m×vx)
La pressione, P, è definita come il rapporto tra la forza, F, e la superficie, S, su cui agisce:
![]()
La forza, invece è definita come variazione della quantità di moto subita dalla particella nell’unità di tempo:
![]()
La pressione esercitata da una particella sulla parete è:
![]()
L’intervallo di tempo Dt è uguale al tempo che impiega la particella a compiere due urti consecutivi sulla stessa parete, ovvero è uguale al tempo che impiega la particella una andata ed un ritorno tra le due pareti del recipiente. Il valore dell’intervallo di tempo si calcola supponendo che la particella si muova di moto rettilineo uniforme. Pertanto:
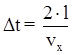
Sostituendo tale quantità nell’espressione della pressione si ha:
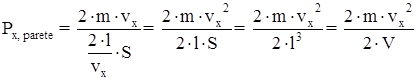
dove V è il volume del recipiente che contiene il gas.
L’espressione della pressione, dopo un semplice elaborazione, può essere scritta anche in questo modo:
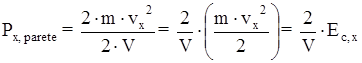
dove Ec, x è l’energia cinetica della particella.
Il gas contenuto nel recipiente è costituito da N particelle, che, in prima approssimazione, si muovono tutte con la stessa velocità lungo la stessa direzione, quella dell’asse delle ascisse. Sotto queste condizioni la pressione totale esercitate dalle particelle sulla parete è:
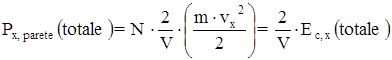
dove Px, parete(totale) è la pressione totale esercitata dalle particelle sulla parete, ed Ec, x(totale) è l’energia cinetica totale di tutte le particelle.
Nel calcolare la pressione totale si è supposto che le particelle avessero tutte la stessa velocità. Nella realtà ogni particella ha una propria velocità, quindi è necessario di modificare l’espressione riguardante la pressione.
Prima, però è necessario introdurre il concetto del valore medio di una grandezza. Il valore medio di una grandezza a, che assume i valori a1, a1, a2, a3, a4, a5, aN, dove N indica il numero di valori della grandezza in esame, è definito come:
![]()
Nel caso che si sta trattando, la grandezza a corrisponde alla grandezza vx2. Allora il valore medio di vx2 verrà indicato con ![]() e prenderà il nome di velocità quadratica media.
e prenderà il nome di velocità quadratica media.
Con questa posizione la pressione totale su di una parete vale:
![]()
dove áEc, x (totale)ñ è l’energia cinetica media delle particelle lungo la direzione x.
In un modello più realistico del moto delle particelle nel recipiente si ha che esse si muovono in tutte le possibili direzioni. Il valore della velocità quadratica media lungo una direzione è identica a quella lungo le altre direzioni, perciò
![]()
Per mettere in relazione le velocità lungo i tre assi, x, y, e z, si considera il moto, con velocità v, di una particella che avviene nel piano x-y.
Le componenti del vettore velocità v lungo le direzioni x e y sono vx e vy. Il modulo della velocità v è collegato alle sue componenti lungo le direzioni x e y dalla relazione pitagorica
v2 = vx2 + vy2 + vz2
da cui si ricava che
![]()
La pressione esercitata dalle particelle su di una parete è uguale a quella esercitata su tutte le pareti, per cui:
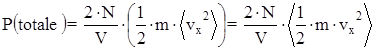
Sostituendo l’espressione della velocità quadratica media lungo la direzione x si ha:
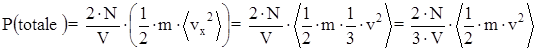
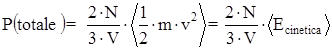
Il risultato ottenuto è di estrema importanza perché mette in relazione una grandezza macroscopica, la pressione esercitata da tutte le N particelle sulle pareti di un recipiente, con l’energia cinetica media delle particelle (aspetto microscopico).
Tenendo presente l’equazione di stato dei gas, questa la si può confrontare con quella ottenuta con il modello cinetico del gas:
P×V = n×R×T = N×k×T
![]()
Dalla uguaglianza dei primi membri delle due equazioni discende che sono uguali anche i secondi membri:
![]()
Da queste espressione si ricava il valore dell’energia cinetica media di tutte le particelle che compongono il gas.
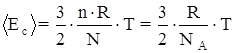
![]()
Dalle due espressioni, che sono strettamente collegate tra di loro, si deduce il significato di temperatura: La temperatura è una misura della energia cinetica media di tutte le particelle che compongono il gas.
Nelle espressioni di sopra, i vari simboli hanno il seguente significato:
n = numero di moli del gas;
N = numero di particelle che compongono il gas; (N = n×NA)
NA = 6,0225´1023 mol-1, numero di Avogadro - Loschmidt;
R = 8,3143 JK-1mol-1, costante dei gas perfetti; (R = NA×k)
k = 1,3805´10-23 JK-1, costante di Boltzmann;
Trascurando le interazioni tra le particelle e, quindi, l’energia potenziale dovuta a tale interazione, l’energia totale delle particelle coincide con la sola energia cinetica. Essa è
Utotale = N×áEcñ
L’energia totale, nell’ipotesi fatta, coincide con la energia interna del sistema:
Uinterna = Utotale = N×áEcñ
Sostituendo l’espressione dell’energia cinetica media si ha:
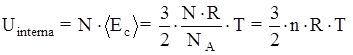
![]()
Anche per l’energia interna esiste uno stretto collegamento con la temperatura assoluta del gas. Pertanto conoscendo la temperatura assoluta del gas è possibile conoscere la sua energia interna.
L’equazione di stato dei gas perfetti in funzione della temperatura assume la seguente forma
![]()
Fonte: http://www.liceolanzafoggia.it/index.php/filemanager/download/351/
Sito web da visitare: http://www.liceolanzafoggia.it
Autore del testo: indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve