I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Un metallo è formato da una moltitudine di piccoli volumi poliedrici, denominati grani, la cui taglia varia fra 2 e 20 mm, limitati da superfici denominate bordi grano. Questa microstruttura granulare è messa bene in evidenza mediante la microscopia elettronica a scansione (figura 1) oppure mediante la microscopia ottica (figura 2).
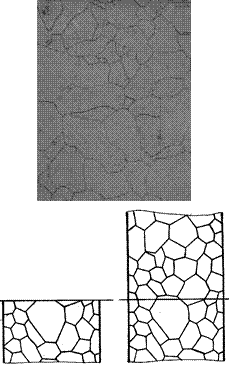

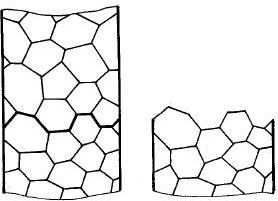
Figura 1: Superficie osservata al microscopio elettronico a scansione (SEM).
Figura 2: Superficie osservata al microscopio ottico.
Ogni grano è un in realtà un monocristallo, cioè un impilamento regolare di ioni metallici positivi la cui coesione è assicurata dal gas di elettroni (mare di Fermi);
Nel caso di un materiale policristallino (figura 3a), l’orientazione del reticolo differisce da grano a grano. Nel caso in cui il materiale è costituito da un solo grano, esso è denominato monocristallino (figura 3b).
Figura 3a Figura 3b
Nei casi più semplici, (metalli puri, soluzioni solide), tutti i cristalli hanno una identica struttura e la stessa composizione: il materiale è detto monofasico. In generale, comunque, i materiali sono polifasici, in cui ognuno dei cristalli con la stessa struttura e composizione formano una fase distinta. Le proprietà macroscopiche di un materiale metallico sono in relazione diretta con la sua struttura cristallina.
L'atomo è costituito da un nocciolo intorno al quale ruotano degli elettroni. Il nocciolo è formato da :
carica positiva e = 1.6 10-19 C;
carica nulla.
Gli elettroni hanno una massa me = mp/1840, ed hanno una carica negativa, pari a -
e.
Il numero di elettroni è uguale al numero Z di protoni: la carica elettrica di un
atomo è quindi complessivamente nulla. Il numero Z, detto numero atomico, permette di classificare gli elementi in ordine crescente rispetto al numero di protoni.
Gli elettroni sono distribuiti intorno al nocciolo su dei livelli elettronici di differenti energie, denominati K, L, M, N... . Ogni livello può contenere un numero massimo di elettroni: 2 per il livello K, 8 per L, 18 per M ...
Gli elettroni hanno una traiettoria complessa intorno al nocciolo, che può essere rappresentata in modo comodo, ma fisicamente non corretto, come una traiettoria circolare. Questo permette di utilizzare un modello dell'atomo "a sfera" centrata su nocciolo, ed il cui raggio è pari a quello di ingombro elettronico (figura 4).
In questa sfera la massa è
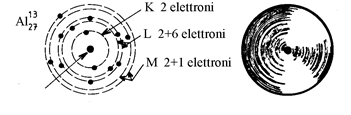
Figura 4
praticamente concentrata nel nocciolo, ed il rapporto
diametro sfera / diametro nocciolo è dell’ordine delle decine di migliaia.
Lo strato elettronico più esterno è il più importante: nel caso in cui lo strato esterno è saturo, l'elemento è molto stabile (gas rari: elio, neon ...). Gli altri elementi possono
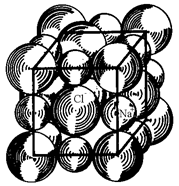
Figura 5
acquistare la struttura stabile:
I legami interatomici sono direttamente legati a questo strato esterno. Essi sono principalmente di tipo ionico, covalente o metallico.
E' il legame che si può avere fra elementi fortemente elettropositivi (metalli) e fortemente elettronegativi (non metalli). L'atomo elettropositivo dona uno o più
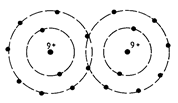 elettroni all'atomo elettronegativo. Questo processo genera degli ioni di cariche opposte. Le forze del legame sono generate dall'attrazione elettrostatica fra gli ioni (figura 5).
elettroni all'atomo elettronegativo. Questo processo genera degli ioni di cariche opposte. Le forze del legame sono generate dall'attrazione elettrostatica fra gli ioni (figura 5).
Questo legame, contrariamente al legame ionico, ha luogo fra elementi vicini nella classificazione periodica. Gli atomi mettono in comune degli atomi per completare gli strati più esterni (figura 6).

Figura 6
E' caratterizzato dal fatto che gli elettroni di legame sono liberi. Si può considerare il metallo come un impilamento di ioni positivi, immersi in una nuvola di elettroni.
Questo impilamento di ioni conduce a delle strutture compatte che possono essere rappresentate come un impilamento regolare di sfere indeformabili (figura 7).
Figura 7
La compattezza si può esprimere attraverso il numero di coordinazione, definito come il numero di ioni tangenti allo stesso ione. Considerato che il numero di coordinazione è 4 per il reticolo del diamante (legame covalente), 6 per il cloruro di sodio (legame ionico), nel caso dei principali metalli tale numero è 8 o 12.
Legame |
Materiale |
Caratteristiche |
Ionico |
NaCl; Al2O3 |
Cattiva conducibilità elettrica, fragile, trasparente |
Covalente |
Si; C (diam.) |
Cattiva conducibilità elettrica, notevole durezza, |
|
|
punto di fusione molto elevato |
Metallico |
Na, Al, Cu, Fe |
Buona conducibilità elettrica e termica, facile |
|
|
deformabilità , opacità |
2.1 Reticoli cristallini.
Un monocristallo geometricamente perfetto è un insieme di ioni regolarmente ripartiti nello spazio. Per descrivere comodamente questa sistemazione, si definisce un reticolo cristallino attraverso un insieme di nodi ottenuti da una maglia elementare che fissa la periodicità tridimensionale di ripetizione di un motivo elementare (figura 8).
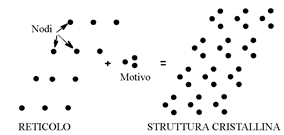
Figura 8
La maglia elementare è definita attraverso tre vettori a, b, c. Dopo aver scelto una origine degli assi, questi vettori sono i vettori di base su Ox, Oy, Oz. Questi sono i
parametri del reticoli. La posizione di uno qualsiasi dei nodi del reticolo è dato dal vettore:
r = u a + v b + w c
ove u, v, w sono degli interi (figura 9).
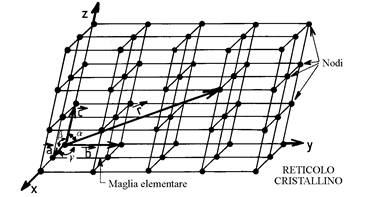
Figura 9
Tutti i reticoli cristallini possono essere descritti a partire da 7 sistemi cristallini descritti nella tabella seguente.
Sistema |
a, b, c |
Esempi |
Triclino |
a ¹ b ¹ c; a ¹ b ¹ g ¹ p/2 |
|
Monoclino |
a ¹ b ¹ c; a = b = g ¹ p/2 |
|
Ortorombico |
a ¹ b ¹ c; a = b = g = p/2 |
Ua, Fe3C |
Quadratico |
a = b ¹ c; a = b = g = p/2 |
Martensitico (acciaio) |
Esagonale |
a = b ¹ c; a = b = p/2 ; g = 2 p/ 3 |
Zn, Mg, Be |
Romboedrico |
a = b = c; a = b = g ¹ p/2 |
As, Sb, Bi |
Cubico |
a = b = c; a = b = g = p/2 |
Fe, Cu, Al, Ni |
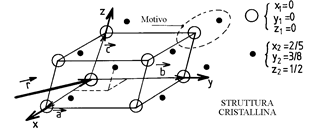
Figura 10
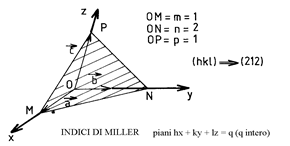
Figura 11
Definito lo spazio come un reticolo di punti, la suddivisione della materia è fissata dall'esistenza di un motivo elementare, definibile come il più piccolo insieme di ioni N di coordinate xi, yi, zi, che, mediante traslazione a partire dal nodo origine, permette di ricostituire tutto il cristallo (figura 10). Ogni nodo è equivalente, ovvero è circondato dallo stesso insieme di ioni che costituisce il motivo elementare. Una struttura è quindi perfettamente definita dalla conoscenza del reticolo cristallini (a, b, c) e del motivo elementare (xi, yi, zi), con i che varia da 1 ad N.
Si definisce piano cristallografico, un piano che passa per tre nodi non
allineati de reticolo. Considerato un tale piano che taglia gli assi Ox, Oy, Oz in M, N, P: tale piano sarà designato dagli indici di Miller h, k, l, definiti come i più piccoli interi proporzionali a 1/m, 1/n, 1/p (figura 11). I valori h, k, l, designano non solo un piano, ma un intero fascio di piani paralleli con : (hkl).1
3.1 Metalli puri.
Le strutture cristalline più frequenti per i metalli puri appartengono al sistema cubico ed al sistema esagonale.
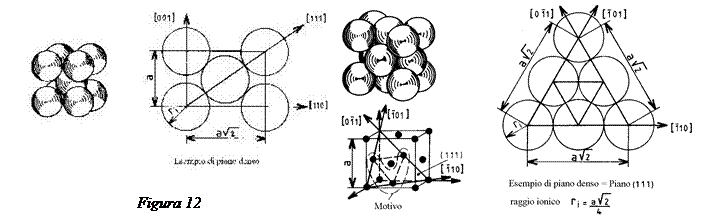
Nelle figure 12-14 sono rappresentate le strutture principali: Cubica Corpo Centrale (CCC), la struttura Cubica a Facce Centrate (CFC), la struttura Esagonale Compatta (EC).2
Per studiare le strutture cristalline, si rappresenta la maglia elementare posizionando al centro gli ioni. Si deve fare attenzione, in quanto tale rappresentazione non mette in evidenza la vera dimensione degli ioni per rapporto ai parametri della maglia. Per ottenere uno schema in scala, si disegnerà ogni volta i piani a massima
Figura 13
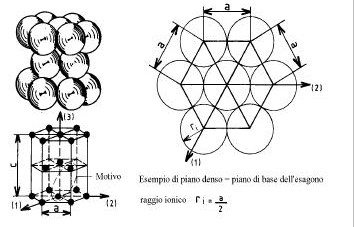
Figura 14
![]()
![]()
1 L'indice negativo è rappresentato con una barra sopra l'indice.
2 Uno stesso elemento (per esempio il ferro, il titanio etc) può presentare diverse strutture cristalline secondo l'intervallo di temperatura considerato. Si dice che l'elemento presenta un polimorfismo cristallino. Il passaggio da una forma ad un all’altra è una trasformazione allotropica:
Caso del ferro:
- 273 °C
compattezza, rappresentando gli ioni con delle sfere dure.
La struttura CCC definita da un motivo a due ioni (uno all'origine, l'altro al centro della maglia). La maglia elementare comprende 2 ioni per maglia ( 1 al centro ed 8 ai vertici del cubo, appartenente ciascuno ad otto maglie). Il numero di coordinazione è uguale a 8.
La struttura CFC definita da un motivo a quattro ioni (uno all'origine, gli altri tre al centro delle facce del cubo). La maglia elementare comprende 4 ioni per maglia (6 sulle facce appartenenti ciascuno a due maglie, 8 ai vertici del cubo, appartenente ciascuno ad otto maglie). Il numero di coordinazione è uguale a 12 (compattezza massima).
La struttura EC definita da un motivo a due ioni. La maglia esagonale rappresentativa comprende 6 ioni per maglia (3 all'interno + 2 sulle basi, comuni ciascuno a due maglie, + 12 sui vertici, ciascuno comune a 6 maglie). Il numero di coordinazione è uguale a 12 (compattezza massima).
Si nota che i piani densi delle strutture CFC e EC sono identici (figura 15).
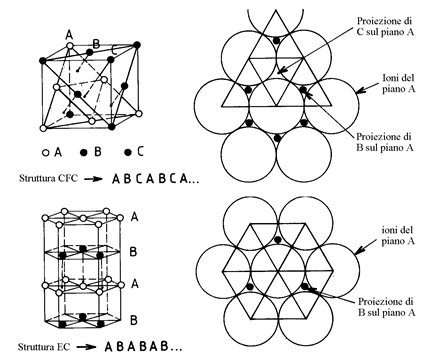
Figura 15
Si può mostrare che le strutture CFC ed EC corrispondono alla compattezza massima, cioè a due modi di impilare i piani compatti di sfere nello spazio.
L'impilamento CFC corrisponde ad un impilamento di piani densi del tipo
L'impilamento EC corrisponde ad un impilamento di piani densi del tipo:
3.2. Strutture cristalline delle leghe
A parte qualche caso particolare, i metalli sono raramente utilizzati allo stato puro, ma sotto forma di leghe che sono ottenute a partire da un metallo base con aggiunte metalliche e non metalliche.
Le leghe possono avere 2 (leghe binarie), 3 (leghe ternarie), ... n elementi. In funzione della temperatura e della composizione, le leghe sono monofasiche o polifasiche.
Una fase è una parte di un materiale fisicamente distinto, meccanicamente separabile, avente una struttura ed una composizione propria. Trascurando lo stato liquido, che non è che transitorio, si distinguono allo stato solido, due tipi di fasi: le soluzioni solide ed i composti definiti, i cui domini di stabilità sono forniti nei diagrammi di equilibrio.
Gli atomi di B possono entrare in soluzione nel reticolo di A :
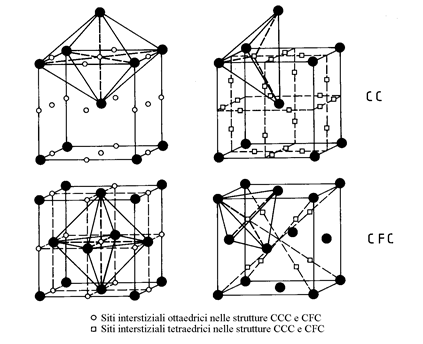
3.2.2. I composti definiti. Questi composti sono stabili solo in uno stretto dominio di composizione
Figura 16
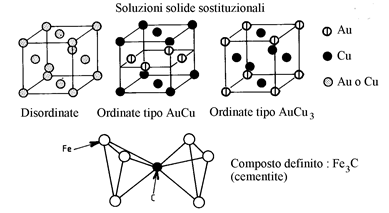 Figura 17
Figura 17
corrispondente ad una stechiometria AmBm. Essi hanno in generale una struttura cristallina differente da A e da B (figura 17).
Esempio: Cu3Al, CuAl2, TiC, NbC, Fe3C.
I cristalli non sono mai perfetti. Ci sono sempre degli "errori" negli impilamenti che possono essere descritti come difetti puntuali, lineari e planari.
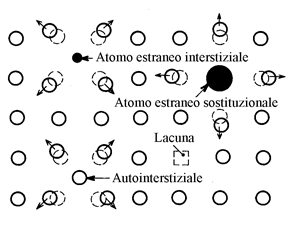
Figura 18
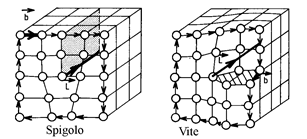
Figura 19
Questi difetti esistono al livello di dimensioni atomiche. Risultano dalla presenza di (figura 18):
Le lacune, che sono alla base del processo di diffusione, sono sempre presenti nel reticolo e la loro concentrazione all'equilibrio varia con la temperatura.
Tali difetti si chiamano dislocazioni e sono all'origine di tutti i processi legati alla deformazione plastica. Tutti i tipi di dislocazione
possono essere rapportati a due tipi: la dislocazione a spigolo e la dislocazione a vite.
La dislocazione a spigolo (figura 19) corrisponde all'introduzione di un semi piano supplementare nel reticolo cristallino che offre l'immagine di uno spigolo. Per definire una dislocazione si utilizza il metodo seguente: si sceglie un verso positivo sulla linea di dislocazione e si traccia un circuito nel cristallo intorno alla dislocazione. Questo circuito presenta un difetto di chiusura b denominato vettore di Burgers. Nel caso della dislocazione a spigolo, b è perpendicolare alla linea della dislocazione.
La dislocazione a vite (figura 19) deve il suo nome al fatto che il cristallo è costituito da una rampa perpendicolare intorno alla linea di dislocazione. Nel caso della dislocazione a vite, b è parallelo alla linea della dislocazione.
La densità delle dislocazioni, che può essere espressa in lunghezza di linea di dislocazione per unità di volume, è dell'ordine di 106-108 cm-2 per un metallo ricotto, 1011-1012 cm-2 per un metallo molto deformato.
Superfici libere: Esse separano il solido dal gas. Molto raramente sono lisce e presentano, su scala atomica, degli scalini.
Ci si associa una energia di superficie che dipende dall'orientazione cristallografica.
Bordi grano: Essi separano regioni caratterizzate da differenti orientazioni cristallografiche. Si distinguono dei bordi a debole disorientazione (<10°), che possono essere descritti come dei semplici arrangiamenti di dislocazioni, ed i bordi a forte disorientazione (>10°), più complessi da definire.
Questi bordi possiedono una energia di interfaccia e rappresentano uno stato metastabile del metallo. Possono muoversi sotto effetto della temperatura, sono il luogo privilegiato della segregazione degli atomi estranei ed inoltre sono degli ostacoli alla propagazione delle dislocazioni.
Interfacce fra due fasi: L'interfaccia separa due fasi differenti. Si distinguono due casi limite:
Fonte: http://www.matteopro.com/images/Ingegneria/Metallurgia/Compendio-di-metallurgia-1.pdf
Sito web da visitare: http://www.matteopro.com/
Autore del testo: Francesco Iacoviello
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve