I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
LA LIOFILIZZAZIONE
Liofilizzare un materiale significa renderlo “liofilo”: rendere liofilo un materiale significa renderlo rapidamente solubile in acqua. Il termine liofilizzazione dunque non è legato al processo di essiccamento, ma è legato alle caratteristiche fisiche del prodotto finale. Questo è una sostanza solida con una elevatissima superficie specifica che rende molto rapida la dissoluzione. Il processo si dovrebbe chiamare CRIO-ESSICCAMENTO, ossia, essiccamento a freddo. Infatti il processo consiste nel congelare la soluzione, facendo passare l’acqua a ghiaccio, e successivamente allontanare l’acqua con il passaggio di stato della sublimazione. Questo processo si adatta bene a materiali molto termolabili che non sopporterebbero nemmeno il trattamento dello spray-drying. Oppure si può fare un crio-essiccamento per fare la liofilizzazione, cioè per ottenere un materiale che si scioglie molto rapidamente in acqua.
Il processo si svolge in tre fasi successive:
1) CONGELAMENTO: in questa fase viene sottratto calore alla soluzione per fare passare l’acqua a ghiaccio. Bisogna però considerare che anche il soluto, ossia il principio attivo, deve solidificare. Non tutta l’acqua cristallizza e la percentuale di acqua che non passa a ghiaccio varia a seconda dei casi. C’è sempre una percentuale di acqua adsorbita, a livello molecolare, sulla superficie del principio attivo solido.
2) ESSICCAMENTO PRIMARIO: in questa fase si ha la sublimazione del ghiaccio.
3) ESSICCAMENTO SECONDARIO o DESORBIMENTO: consiste nell’allontanamento dell’acqua adsorbita.
Una soluzione di principio attivo prima di essere sottoposta al processo di liofilizzazione ha bisogno di pretrattamenti.
Uno è la certamente la sterilizzazione, perché i liofilizzati farmaceutici sono destinati alla somministrazione parenterale. Deve essere sterilizzata la soluzione di partenza e non il liofilizzato finale. Infatti, la liofilizzazione si applica in genere a materiali termolabili e, in generale, chimicamente poco stabili. Questo significa che il liofilizzato finale non può essere sterilizzato con calore né con raggi gamma o ossido di etilene. Allora si deve sterilizzare la soluzione di partenza e condurre la liofilizzazione in condizioni rigorosamente asettiche. La soluzione di partenza viene sterilizzata con il metodo della filtrazione sterilizzante. Se la soluzione di partenza è torbida allora deve essere sottoposta previamente a una filtrazione chiarificante.
Un altro fattore importante da considerare è la concentrazione della soluzione di partenza, che non può essere inferiore ad un certo valore limite perché altrimenti il liofilizzato che si ottiene alla fine non ha sufficiente stabilità meccanica. Il liofilizzato è un solido poroso rigido dotato di una elevata superficie specifica. I pori presenti nel liofilizzato finale non sono altro che gli spazi lasciati liberi dai cristalli di ghiaccio che è sublimato. Alla fine del processo il liofilizzato secco occupa lo stesso volume della soluzione di partenza. Perciò se si parte da una soluzione troppo diluita, ad es., al 2%, il 98% del volume alla fine resta vuoto. Evidentemente un liofilizzato così non può essere stabile meccanicamente. Da ciò si conclude che la concentrazione non deve essere minore del 15-20%.
I principi attivi con elevata attività farmacologica, devono essere somministrati a basse dosi. Il liofilizzato monodose deve contenere una quantità piccola o molto piccola di principio attivo. In questi casi è necessario aggiungere al farmaco un eccipiente (che allo stato anidro è solido) che sia biologicamente inerte, come albumina o lattosio. Questo diluente conferisce la massa, e dunque, la stabilità meccanica necessaria al liofilizzato.
CONGELAMENTO DELLA SOLUZIONE ACQUOSA DI UNA SOSTANZA
Aspetti termodinamici
Per capire i fenomeni che avvengono quando si congela la soluzione di una sostanza consideriamo il diagramma di stato di un sistema binario costituito da acqua e soluto. Questi due componenti, a certe temperature sono miscibili ad altre non lo sono. Consideriamo il diagramma di stato di tale sistema alla pressione atmosferica:
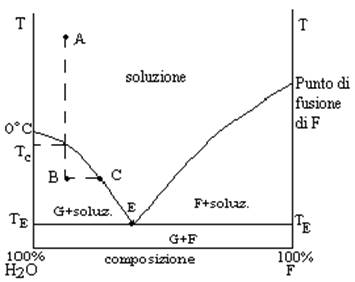
Fig.1
G indica il ghiaccio
F indica il farmaco
Tc è il punto di congelamento della soluzione
B indica la temperatura e la composizione della miscela soluzione–ghiaccio;
C indica la temperatura e la composizione della soluzione in equilibrio con il ghiaccio.
In ogni zona del diagramma il sistema si presenta in modo diverso: nella zona in alto esiste la miscela liquida dei due componenti completamente miscibili. Poi c’è una zona in cui esiste ghiaccio in equilibrio con una soluzione di farmaco (G+soluz.). Quindi, c’è un settore in cui il componente solido è il farmaco in equilibrio con la soluzione del farmaco stesso (F+soluz.). Infine, nella zona più bassa esistono due fasi solide, ghiaccio e farmaco (G+F).
La curva che ci interessa di più è quella di sinistra: un punto su questa curva indica condizioni di temperatura e di composizione della soluzione in equilibrio con il ghiaccio. Un punto all’interno del settore sotteso dalla stessa curva indica le condizioni di temperatura e composizione di una miscela costituita da ghiaccio e soluzione. Se voglio sapere qual è la composizione della soluzione in equilibrio con il ghiaccio in una miscela avente temperatura e composizione corrispondenti, ad es., al punto B (Fig. 1) devo cercare il punto sulla curva che corrisponde alla temperatura che si considera (punto C, Fig. 1).
Se una soluzione acquosa viene portata ad una temperatura tale che si separa del ghiaccio, è ovvio che la soluzione si concentra.
Se il sistema è costituito da acqua pura, la temperatura alla quale l’acqua pura è in equilibrio con il ghiaccio è 0°C (alla pressione di 1atm).
Considerando la curva di destra, in questo caso la fase solida è costituita dal farmaco: se consideriamo il farmaco puro cioè, se ci poniamo sull’asse delle ascisse in corrispondenza del 100% di farmaco, l’ordinata del corrispondente punto sulla curva sarà il punto di fusione del farmaco alla pressione di 1atm, cioè la temperatura alla quale il farmaco solido è in equilibrio con il farmaco liquido (fuso).
Nei punti sulla linea retta orizzontale il sistema è in condizioni diverse a seconda che essi si trovino a sinistra o a destra del punto triplo. Infatti, a sinistra del punto triplo, per tutte le composizioni comprese tra il 100% di acqua e il punto E il sistema è costituito da:
1) una fase liquida, che è una soluzione con una composizione corrispondente al punto E ;
2) ghiaccio;
3) una miscela ghiaccio-farmaco solido. Questa miscela si forma quando la temperatura corrisponde al punto E. Questa miscela di due fasi solide, G+F, che si forma al punto E, ha la composizione definita da tale punto; essa si definisce miscela eutettica e la temperatura TE è il punto eutettico.
Se si prende un punto sulla linea orizzontale a destra del punto eutettico questo corrisponde a un sistema costituito dalle fasi descritte ai punti 1) e 3) e da F solido.
Al punto E il sistema è costituito dalle fasi di cui ai punti 1) e 3).
C’è una differenza dal punto di vista fisico tra il ghiaccio che si forma quando il sistema si trova nelle condizioni corrispondenti ai punti nel settore G+soluz. e il ghiaccio che si forma quando esso si trova alla TE. La miscela eutettica allo stato solido è costituita da due fasi solide G+F mescolate intimamente e costituite da cristalli molto piccoli. I cristalli di ghiaccio e di farmaco costituenti la miscela eutettica sono perciò molto più piccoli di quelli che si trovano nel sistema G+soluz. o F+soluz.
Supponiamo di sottrarre calore a una soluzione acquosa che contiene una certa concentrazione di farmaco, a partire da una temperatura uguale a quella dell’ambiente, alla pressione di 1atm (punto A, Fig. 1). La soluzione si raffredda, senza che ci sia altro cambiamento, e la temperatura scende fino al punto di congelamento. A questo punto la soluzione è in equilibrio con il ghiaccio. Se si continua a sottrarre calore si forma ghiaccio. La miscela non cambia composizione, mentre cambia la composizione della soluzione in equilibrio con il ghiaccio. Se si passa dal punto iniziale A al punto B la miscela mantiene la sua composizione, ma la composizione della soluzione in equilibrio con il ghiaccio cambia (da A passa a C): la soluzione si è concentrata. Continuando a sottrarre calore la temperatura scende e contemporaneamente si forma una quantità sempre più grande di ghiaccio e la soluzione in equilibrio con i cristalli di ghiaccio è sempre più concentrata. Questa soluzione prende il nome di soluzione interstiziale perché il ghiaccio si forma in tutto il volume del sistema (almeno in teoria, perché si suppone che la diminuzione di temperatura sia uniforme nel sistema) e la soluzione in equilibrio con il ghiaccio si trova negli interstizi tra i cristalli di ghiaccio. Quando la temperatura raggiunge il punto eutettico, allora si forma la miscela eutettica solida costituita da cristalli molto piccoli di ghiaccio intimamente mescolati con cristalli di farmaco, anch’essi molto fini. La soluzione interstiziale a questo punto ha la composizione della miscela eutettica. Se si continua a sottrarre calore continua a formarsi la miscela eutettica solida. Al punto eutettico solidifica la soluzione interstiziale mantenendo inalterata la sua composizione; siamo a un punto in cui, sottraendo calore, le variabili non cambiano. Quando il sistema è completamente solido, esso è interamente costituito da cristalli di ghiaccio e, negli interstizi tra tali cristalli, ci saranno i cristalli molto più fini della miscela eutettica. Continuando a sottrarre calore, la temperatura riprende a scendere. Liofilizzando il sistema congelato si avrà la sublimazione dei cristalli di ghiaccio, che lasceranno degli spazi vuoti, e il farmaco liofilizzato che si ottiene alla fine avrà la forma di una spugna rigida con numerosi e piccoli pori.
La composizione della soluzione interstiziale, quando si forma la miscela eutettica, cambia a seconda del tipo di farmaco: miscele eutettiche ottenute con soluzioni di farmaci diversi sono più o meno ricche di farmaco.
Aspetti cinetici
Consideriamo l’aspetto cinetico dei fenomeni che si verificano nel congelamento tramite il diagramma T rispetto al tempo. Nel diagramma di Fig. 2 si suppone in un primo momento che la soluzione che si congela sia ideale e che il sistema sia in equilibrio quasi–stazionario durante il congelamento.
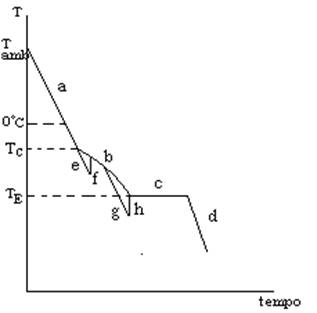
Fig. 2
Al tempo zero il sistema è una soluzione acquosa del farmaco e la temperatura è uguale alla temperatura ambiente. Supponiamo di sottrarre calore a velocità costante, allora la temperatura scende linearmente (tratto a) perché quello che viene sottratto alla soluzione è calore sensibile, finché si arriva alla temperatura alla quale comincia a formarsi il ghiaccio (Tc, v. Figg.1 e 2). Questa temperatura è inferiore a 0°C. Quando comincia a formarsi ghiaccio si ha emissione di calore latente di fusione che provoca una discontinuità nel diagramma di Fig. 2. La temperatura diminuisce fino alla temperatura del punto eutettico (tratto b). Al punto eutettico la solidificazione della miscela eutettica avviene con emissione di calore latente e senza variazione di composizione, per cui, durante la solidificazione della miscela eutettica la temperatura rimane costante (tratto c); continuando a sottrarre calore, tale calore è calore sensibile, poiché non ci sono più passaggi di stato. Allora si ha un raffreddamento lineare se si sottrae calore a velocità costante (tratto d). Queste trasformazioni sono teoriche, perché si suppone che il sistema sia sempre in condizioni di equilibrio termodinamico. Nella realtà non si ottiene mai un diagramma così. Riassumendo:
Grafico ideale (v. Fig. 2):
Un diagramma reale temperatura-tempo che si ottiene quando si congela una soluzione mostra diverse deviazioni dall’idealità, le quali dipendono dal tipo di soluto. Consideriamo come soluto una sostanza a basso peso molecolare, cosicché il diagramma non devia molto dal comportamento teorico. Nella pratica il calore viene sottratto ad una velocità piuttosto elevata: la soluzione viene messa a contatto con una sorgente fredda, avente una temperatura costante. Questo significa che quando si arriva al punto in cui teoricamente si dovrebbe avere la formazione di ghiaccio, in realtà ciò non si verifica perché la soluzione si sovraraffredda: il sistema non è all’equilibrio termodinamico bensì in condizioni di equilibrio metastabile. In realtà si ha una deviazione dal grafico ideale, rappresentata dal tratto e (Fig. 2). E’ sufficiente un evento casuale perché si “rompa” l’equilibrio metastabile: si ha, allora, la formazione di cristalli di ghiaccio perché il sistema si riporta rapidamente alle condizioni di equilibrio termodinamico. La temperatura aumenta fino a incontrare la curva teorica (tratto f, Fig. 2): questa è la prima deviazione dalla teoria.
Dopo che è congelata la maggior parte dell’acqua, la soluzione interstiziale è molto concentrata. A tale concentrazione, la velocità con cui le molecole in tale soluzione si organizzano nel reticolo cristallino non è sufficiente a mantenere il sistema all’equilibrio termodinamico, per cui si ha sovraraffreddamento della soluzione interstiziale fin sotto il punto eutettico (tratto g). Se il soluto ha basso peso molecolare e mantiene una certa mobilità molecolare, anche se è sovraraffreddato può, a un certo punto, formare germi cristallini. Allora cristallizza la miscela eutettica e il sistema ritorna nelle condizioni di equilibrio termodinamico (tratto h). Riassumendo:
Deviazioni dall’idealità (v. Fig. 2):
Vediamo adesso come si presenta il diagramma temperatura-tempo registrato dagli strumenti di controllo nel processo di congelamento della soluzione di una sostanza di peso molecolare relativamente basso:
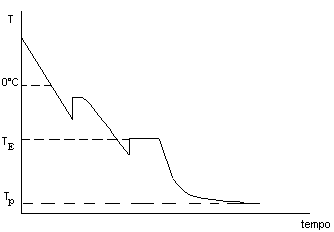
Fig. 3
Nella maggior parte dei casi il congelamento viene fatto mettendo il contenitore con il materiale da congelare a contatto con una piastra raffreddata che viene mantenuta alla temperatura Tp. Quando il sistema è completamente congelato, allora non c’è più emissione di calore latente e tende ad equilibrarsi termicamente con la piastra di raffreddamento (![]() ). Questo è il caso in cui il soluto ha un peso molecolare relativamente basso, e quindi, mobilità delle molecole tale da permettere una rapida organizzazione nel reticolo cristallino.
). Questo è il caso in cui il soluto ha un peso molecolare relativamente basso, e quindi, mobilità delle molecole tale da permettere una rapida organizzazione nel reticolo cristallino.
Un requisito fondamentale del liofilizzato è quello di avere pori piccoli e numerosi, affinché il liofilizzato stesso abbia una elevata superficie specifica che assicura una rapida dissoluzione. Bisogna perciò fare in modo che i cristalli di ghiaccio che si formano siano piccoli e numerosi. Se si facesse il congelamento in condizioni di equilibrio termodinamico i cristalli di ghiaccio sarebbero grandi, perché la velocità del processo sarebbe bassa e allora i cristalli si accrescerebbero a partire da pochi centri di cristallizzazione. Per avere un liofilizzato soddisfacente il sovraraffreddamento è una necessità (tratto e, Fig. 2), perché, quando i cristalli di ghiaccio si formano a partire da una soluzione sovraraffreddata in equilibrio metastabile la formazione del ghiaccio, quando l’equilibrio viene rotto, è molto rapida (tratto f, Fig. 2) per cui i centri di cristallizzazione sono numerosi e i cristalli di ghiaccio sono piccoli. Perciò conviene che avvenga il sovraraffreddamento. Per far avvenire ciò occorre sottrarre calore in modo piuttosto rapido. Bisogna tenere presente però che se la velocità con cui si sottrae calore è eccessiva possono capitare inconvenienti. La velocità di sottrazione del calore dal sistema dipende direttamente dai gradienti di temperatura che si creano nel sistema. Il calore viene sottratto con il meccanismo della conduzione quindi se la velocità di sottrazione del calore è elevata allora sono elevati i gradienti di temperatura. In genere il congelamento della soluzione si fa ponendo il contenitore a contatto con una piastra raffreddata, dunque, la temperatura più bassa sarà sul fondo della soluzione, la temperatura più alta sarà invece sulla superficie. Se la differenza di temperatura tra il fondo e la superficie del materiale da congelare è molto grande, come accade quando si realizza una elevata velocità di sottrazione del calore, la temperatura alla quale comincia a formarsi ghiaccio viene raggiunta prima sul fondo che sulla superficie della soluzione. Di conseguenza si comincia a formare ghiaccio sul fondo mentre in superficie la soluzione è ancora allo stato liquido. Ciò provoca una migrazione del soluto verso la superficie della soluzione, per cui la soluzione in superficie si concentra. Questo ha come conseguenza diretta che la superficie della soluzione congela ad una temperatura più bassa di quella del fondo del contenitore. Il sistema diventa disomogeneo, cioè, ricco di ghiaccio e povero di materiale farmaceutico sul fondo, ricco di materiale e povero di ghiaccio sulla superficie. Quando avviene la sublimazione al posto del ghiaccio si formano dei vuoti. Sulla superficie ci sarà una bassa porosità, perché c’è poco ghiaccio (si crea un “tappo” di materiale farmaceutico). Man mano che procede la sublimazione sublima anche il ghiaccio sul fondo. Questo ghiaccio si trasforma in vapore che deve attraversare lo strato di materiale farmaceutico superficiale che è poco poroso. Evidentemente la pressione che deve avere il vapore per attraversare lo strato superficiale può diventare abbastanza grande da fratturare il liofilizzato. Il liofilizzato che si ottiene alla fine non ha una porosità equamente distribuita nel suo volume. Come risultato il liofilizzato si può rompere e la parte superiore sale nel flacone spinta dalla pressione del vapore. Un liofilizzato così non è accettabile e l’operazione così condotta è sbagliata. Ciò è conseguenza degli eccessivi gradienti di temperatura che si sono generati nella fase di congelamento.
Bisogna perciò regolare la temperatura della sorgente fredda in modo appropriato per evitare che la disomogeneità dei pori sia eccessiva, altrimenti il liofilizzato addirittura si rompe.
La tecnica di congelamento più comune è il congelamento statico, che consiste nel porre i contenitori (fiale o fialoidi) contenenti la soluzione sulla piastra raffreddata. Per limitare la differenza di temperatura tra superficie e fondo della soluzione da raffreddare l’altezza della soluzione (ossia la distanza tra il fondo e la superficie della soluzione) non può essere troppo grande: al massimo può essere 1cm. Questo pone un limite al volume, che però non è poi un grave limite, perché i liofilizzati sono in genere preparati monodose e le dosi sono abbastanza piccole da richiedere volumi piccoli di liofilizzato.
ESSICCAMENTO PRIMARIO
Passiamo adesso ad analizzare il secondo stadio del processo, cioè, l’essiccamento primario, che consiste nella sublimazione del ghiaccio. La Fig. 4 mostra uno schema semplificato di un liofilizzatore.
Esso è costituito da una camera che contiene una serie di piastre disposte una sopra l’altra. Nella Fig.4 è rappresentato, a scopo esemplificativo, un flacone su una piastra all’interno della camera. Questa camera deve essere a tenuta di vuoto e comunica con un altro vano attraverso una valvola a farfalla, in modo che il vano possa essere escluso dalla camera, oppure, messo in comunicazione con essa. Generalmente il congelamento statico viene fatto nella camera, che si chiama autoclave (perché deve sopportare alti gradi di vuoto, che si realizzano quando si passa alle fasi di essiccamento).
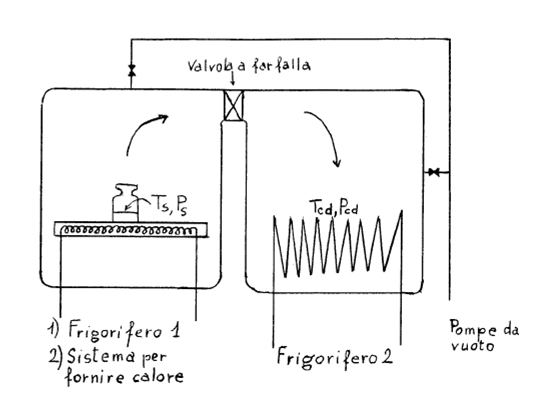
Fig. 4
Il congelamento si fa a pressione ambiente. L’autoclave deve essere chiusa e isolata per motivi di asetticità. In tale fase si devono inserire delle sonde termometriche in flaconi–campione per registrare il grafico T vs tempo.
Nel corso della sublimazione bisogna fornire calore, perché la sublimazione del ghiaccio assorbe il calore latente di sublimazione. Per questo le piastre su cui poggiano i flaconi devono essere riscaldate. Comunque si deve evitare che la temperatura salga tanto da far fondere la miscela interstiziale nel materiale congelato. Dunque, si pongono due necessità: 1)fornire calore e 2)allontanare rapidamente il vapore che si forma, perché solo così si mantiene bassa la temperatura del materiale. Se si lasciasse accumulare vapore sulla superficie del ghiaccio aumenterebbe la temperatura. Per trasferire rapidamente il vapore che si forma si usa il vuoto, perciò, sia all’autoclave che al vano condensatore sono collegate pompe da vuoto.
Nella fase di essiccamento primario la valvola a farfalla è aperta per consentire al vapore di essere allontanato. Queste pompe allontanano l’aria dal liofilizzatore perché l’aria non deve ostacolare la diffusione del vapore. Invece, non sono le pompe da vuoto che allontanano il vapore. Infatti, la quantità di vapore che si forma nell’unità di tempo è troppo grande per la portata delle pompe. Allora si usa un condensatore dotato di una grande superficie raffreddata su cui il vapore sublima a ghiaccio. Il condensatore è disposto nel vano collegato all’autoclave.
La sublimazione del ghiaccio nel materiale congelato avviene perché viene fornito il calore di sublimazione al materiale. Le piastre, oltre ad avere all’interno delle serpentine in cui scorre il fluido frigorigeno, hanno anche altre serpentine in cui scorre un fluido, esternamente riscaldato, in modo che la temperatura della piastra sia controllabile e che la piastra serva non solo a sottrarre calore per il congelamento, ma anche a fornire calore nell’essiccamento primario.
Dopo aver fatto il vuoto, si fornisce calore in modo che il ghiaccio sublimi. Ts è la temperatura della superficie sublimante. Alla Ts corrisponde una Ps, tensione di vapore sul ghiaccio. Il condensatore, mediante un impianto frigorifero diverso da quello collegato alle piastre, viene portato ad una temperatura Tcd. Si deve verificare: Ts>Tcd. Il vapore che arriva sulla superficie del condensatore, che ha una temperatura Tcd<Ts, passa a ghiaccio. Il vapore in equilibrio con questo ghiaccio avrà una pressione di vapore Pcd, e siccome Ts>Tcd, allora si avrà anche: Ps>Pcd. Poiché il vapore si muove da una pressione più alta a una più bassa, esso passa dal materiale al condensatore, dove sublima a ghiaccio. Sul condensatore si accumula uno strato di ghiaccio il che pone un problema. Il condensatore deve sottrarre calore al vapore e farlo sublimare (passaggio vapore–ghiaccio) ad una velocità tale da evitare un accumulo di vapore nell’impianto. Quando il calore passa dal vapore al condensatore, deve attraversare lo strato di ghiaccio depositato sulla superficie del condensatore. La velocità di tale trasferimento di calore si può esprimere con la seguente equazione che è valida nel caso del trasferimento di calore per conduzione:
![]()
dove: q(t) è la velocità istantanea di trasferimento di calore, k è la conducibilità termica del ghiaccio, A è l’area della superficie del condensatore, L è lo spessore del ghiaccio, e DT è la caduta di temperatura attraverso lo strato di ghiaccio.
Se L aumenta troppo, ciò provoca una diminuzione di q(t) e, quindi, come vedremo meglio in seguito, una diminuzione della velocità complessiva del processo. Allora, siccome L non deve aumentare troppo, la superficie del condensatore deve essere dimensionata adeguatamente rispetto alla capacità del liofilizzatore.
Nell’essiccamento primario si deve raggiungere uno stato stazionario, o quasi-stazionario, descritto dalla seguente relazione, che prevede che non ci sia accumulo di vapore e di calore in nessuna parte dell’impianto:
![]() Eq. 1
Eq. 1
dove:
![]() rapporto tra la velocità di trasferimento di calore e il calore latente specifico di sublimazione;
rapporto tra la velocità di trasferimento di calore e il calore latente specifico di sublimazione;
![]() velocità di sublimazione;
velocità di sublimazione;
![]() = velocità di diffusione del vapore dalla superficie sublimante.
= velocità di diffusione del vapore dalla superficie sublimante.
La velocità di essiccamento primario in condizioni di stato stazionario o quasi–stazionario, ottenuta esplicitando l’Eq (1) in funzione delle grandezze importanti che la esprimono, è la seguente:
![]() Eq. 2
Eq. 2
VE(t) = velocità istantanea di essiccamento
A = area della sezione del materiale attraversata dal calore
lS = calore latente di sublimazione del ghiaccio
kint = conducibilità termica dell’intercapedine tra superficie della piastra e fondo del flacone
Lint = spessore dell’intercapedine tra fondo del flacone e superficie della piastra
Tp = temperatura della piastra
Ts = temperatura della superficie sublimante del materiale
Ps = pressione di vapore sulla superficie sublimante del materiale
Pcd = pressione del vapore sulla superficie del condensatore
Rl = resistenza opposta dal liofilizzato alla diffusione del vapore
Su quali grandezze si può giocare per avere la massima velocità di essiccamento possibile?
Il liofilizzato ha una certa porosità e una certa superficie specifica. Per essere un liofilizzato di qualità deve avere una elevata superficie specifica perché così si ridiscioglierà in acqua rapidamente. Se ha una elevata superficie specifica sarà elevato il valore della resistenza diffusionale che il vapore incontra attraversando il liofilizzato (Rl). Infatti, in questo caso i pori de liofilizzato sono piccoli e numerosi, per cui il percorso del vapore che lo attraversa è molto tortuoso e ostacolato. Tale resistenza è funzione diretta dello spessore del liofilizzato, f(Ll):
![]() Eq. 3
Eq. 3
dove:
A è l’area della sezione orizzontale del liofilizzato. Poiché si suppone che la superficie della piastra sia interamente occupata dai flaconi di materiale, A sarà circa uguale all’area della superficie della piastra.
![]() è una caratteristica del materiale. Poiché una elevata superficie specifica è un requisito del liofilizzato, un elevato valore di Rl sarà inevitabile.
è una caratteristica del materiale. Poiché una elevata superficie specifica è un requisito del liofilizzato, un elevato valore di Rl sarà inevitabile.
Allora, ottimizzare la VE significa regolare le variabili del processo in modo che Rl sia il fattore che limita la velocità del processo. Solo così tale velocità sarà massimizzata.
Nella Eq. 3, che esprime la resistenza diffusionale, compare al denominatore l’area della piastra, al numeratore una funzione diretta dello spessore del liofilizzato. Con l’intento di massimizzare la velocità di essiccamento si potrebbe pensare di minimizzare ![]() , non facendo però variare la superficie specifica o la porosità del liofilizzato (sono caratteristiche del materiale che non si possono variare), ma minimizzando Ll lo spessore del liofilizzato. Questo però non è conveniente. Infatti, siccome ogni flacone deve contenere un volume determinato di materiale, se diminuisce lo spessore aumenta la sezione del flacone, e quindi diminuisce il numero di flaconi sulla piastra, cioè diminuisce il numero di unità nel lotto di materiale. In effetti, in genere si massimizza lo spessore per avere un lotto più numeroso.
, non facendo però variare la superficie specifica o la porosità del liofilizzato (sono caratteristiche del materiale che non si possono variare), ma minimizzando Ll lo spessore del liofilizzato. Questo però non è conveniente. Infatti, siccome ogni flacone deve contenere un volume determinato di materiale, se diminuisce lo spessore aumenta la sezione del flacone, e quindi diminuisce il numero di flaconi sulla piastra, cioè diminuisce il numero di unità nel lotto di materiale. In effetti, in genere si massimizza lo spessore per avere un lotto più numeroso.
L’Eq. 2 suggerisce di massimizzare la differenza ![]() . Un fattore aggiustabile è sicuramente
. Un fattore aggiustabile è sicuramente ![]() , cioè la pressione del vapore sulla superficie del condensatore. Si può far diminuire, diminuendo la temperatura del condensatore (la pressione del vapore sul condensatore su cui si deposita ghiaccio dipende direttamente dalla temperatura). La temperatura deve essere abbassata fino a rendere
, cioè la pressione del vapore sulla superficie del condensatore. Si può far diminuire, diminuendo la temperatura del condensatore (la pressione del vapore sul condensatore su cui si deposita ghiaccio dipende direttamente dalla temperatura). La temperatura deve essere abbassata fino a rendere ![]() trascurabile rispetto a
trascurabile rispetto a ![]() : Pcd @ 0.15Ps. In questo modo
: Pcd @ 0.15Ps. In questo modo ![]() non influisce sulla velocità, che è controllata esclusivamente da
non influisce sulla velocità, che è controllata esclusivamente da ![]() . Il valore di
. Il valore di ![]() però, non deve essere diminuito eccessivamente per due motivi:
però, non deve essere diminuito eccessivamente per due motivi:
1) ciò comporterebbe un grande aumento della potenza assorbita dall’impianto frigorifero, per cui, se la differenza Ps-Pcd non viene aumentata in modo sostanziale dalla diminuzione di Pcd, tale diminuzione in realtà determina solo un aumento del costo di produzione;
2) perché così diminuisce la pressione in tutto l’impianto e quindi anche nella camera in cui avviene la liofilizzazione, e in particolare, anche nell’intercapedine tra i flaconi e la superficie della piastra. Se avviene ciò, diminuisce anche la conducibilità termica dell’intercapedine, allora, per valori troppo bassi di pressione l’intercapedine diventa il fattore che controlla la velocità del processo. Questo non conviene perché il processo rallenta. Dunque, a parità di ![]() (pressione del vapore sulla superficie del congelato), se si diminuisse progressivamente la pressione totale la velocità di essiccamento aumenterebbe fino ad un massimo e poi diminuirebbe, perché, per valori di pressione molto bassi, il processo è controllato dal trasferimento di calore, il quale rallenta al diminuire della pressione perché aumenta la resistenza termica dell’intercapedine tra piastra e flaconi.
(pressione del vapore sulla superficie del congelato), se si diminuisse progressivamente la pressione totale la velocità di essiccamento aumenterebbe fino ad un massimo e poi diminuirebbe, perché, per valori di pressione molto bassi, il processo è controllato dal trasferimento di calore, il quale rallenta al diminuire della pressione perché aumenta la resistenza termica dell’intercapedine tra piastra e flaconi.
Si deve ottimizzare l’allontanamento del vapore perché si parte dal presupposto che debba essere la ![]() a determinare la velocità di essiccamento. In tal caso la velocità di essiccamento sarà la massima possibile consentita dai requisiti del materiale. Per aumentare la differenza
a determinare la velocità di essiccamento. In tal caso la velocità di essiccamento sarà la massima possibile consentita dai requisiti del materiale. Per aumentare la differenza ![]() , nell’Eq. 2, si potrebbe pensare di aumentare
, nell’Eq. 2, si potrebbe pensare di aumentare ![]() aumentando la temperatura
aumentando la temperatura ![]() , alla superficie sublimante. Si deve però tenere conto di un limite: infatti la temperatura del materiale congelato non può superare la temperatura di rammollimento della miscela interstiziale. In definitiva, la temperatura della piastra deve essere tale da portare
, alla superficie sublimante. Si deve però tenere conto di un limite: infatti la temperatura del materiale congelato non può superare la temperatura di rammollimento della miscela interstiziale. In definitiva, la temperatura della piastra deve essere tale da portare ![]() al valore massimo possibile e la temperatura del condensatore deve essere ottimizzata in modo che Pcd sia circa uguale a 0.15Ps.
al valore massimo possibile e la temperatura del condensatore deve essere ottimizzata in modo che Pcd sia circa uguale a 0.15Ps.
A questo punto ci si può chiedere se il processo avviene in condizioni di stato stazionario (velocità costante nel tempo) o quasi-stazionario (velocità variabile nel tempo).
Nel momento in cui si è affermato che si cerca di fare in modo che il processo sia regolato dalla resistenza diffusionale del liofilizzato (Rl), automaticamente si afferma che lo stato è quasi-stazionario. Infatti, la velocità globale del processo è inversamente proporzionale alla Rl (v. Eq. 2) la quale dipende direttamente dallo spessore del liofilizzato che nel corso dell’essiccamento primario aumenta (v. Eq. 3 e Fig. 5).
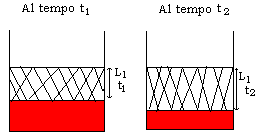
Fig. 5
Quindi, poiché nell’Eq. 2 ![]() è al denominatore, allora la velocità di essiccamento diminuisce nel tempo. Diminuiscono entrambi i membri dell’Eq. 2. Nel primo membro, che esprime la velocità di trasferimento di calore, diminuisce la differenza Tp-Ts. Se l’impianto è dotato di un sistema di termostatazione del materiale, Ts, che è molto vicina alla temperatura media nel materiale, rimane costante nel tempo. Dunque, Tp diminuisce nel tempo. Viceversa, se vengono termostatate le piastre, Tp rimane costante e aumenta la temperatura del materiale. D’altra parte, teniamo presente che quanto sopra esposto è giusto solo se si presuppone che la velocità dell’intero processo sia controllata dalla resistenza diffusionale del liofilizzato.
è al denominatore, allora la velocità di essiccamento diminuisce nel tempo. Diminuiscono entrambi i membri dell’Eq. 2. Nel primo membro, che esprime la velocità di trasferimento di calore, diminuisce la differenza Tp-Ts. Se l’impianto è dotato di un sistema di termostatazione del materiale, Ts, che è molto vicina alla temperatura media nel materiale, rimane costante nel tempo. Dunque, Tp diminuisce nel tempo. Viceversa, se vengono termostatate le piastre, Tp rimane costante e aumenta la temperatura del materiale. D’altra parte, teniamo presente che quanto sopra esposto è giusto solo se si presuppone che la velocità dell’intero processo sia controllata dalla resistenza diffusionale del liofilizzato.
Invece, se la superficie specifica del liofilizzato non è molto grande, oppure se si ha un collassamento del liofilizzato nel corso del processo a causa di un rammollimento, allora si avrebbe una drastica diminuzione della resistenza diffusionale del liofilizzato e quindi tale resistenza non sarebbe più rate-determining (controllante la velocità). Se si verifica ciò, la resistenza opposta dall’intercapedine tra piastra e fondo dei flaconi al trasferimento di calore diviene rate-determining. Poiché tale resistenza non varia nel tempo, lo stato è stazionario, per cui la velocità di essiccamento è costante.
Come si è visto nei liofilizzatori ci sono due alternative:
1) si possono termostatare le piastre a una temperatura prefissata;
2) si può termostatare il materiale congelato ad una temperatura prefissata, usando delle piccole sonde termometriche, dette resistori, che vengono inserite in flaconi rappresentativi. Si collegano ad un sistema di termostatazione che interrompe il riscaldamento quando la temperatura supera un valore precedentemente impostato. La temperatura prefissata (T0) deve essere la massima possibile, sempre avendo cura che non si raggiunga il rammollimento della miscela interstiziale. Per questo motivo, si imposta la ![]() in modo che sia: T0@Tfi, dove con Tfi si indica la temperatura di fusione della miscela interstiziale.
in modo che sia: T0@Tfi, dove con Tfi si indica la temperatura di fusione della miscela interstiziale.
Dunque, con il sistema di termostatazione del materiale congelato, nel corso dell’essiccamento primario deve gradualmente diminuire la temperatura della piastra riscaldante. Esiste anche un altro modo di operare: invece del materiale si termostata la piastra. Per adesso consideriamo il caso più conveniente (anche se necessita di una strumentazione più sofisticata), in cui si termostata il materiale.
Vediamo come il processo viene “monitorato” registrando continuamente nel tempo la temperatura del materiale e delle piastre dall’inizio del processo, cioè dal congelamento fino alla fine dell’essiccamento secondario:
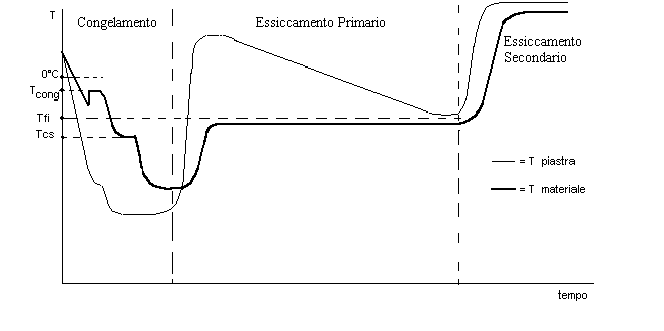
Fig. 6
Il diagramma in Fig. 6 si riferisce al caso in cui sia termostatato il materiale durante la fase di essiccamento primario. Il tempo dell’intero processo di liofilizzazione è piuttosto lungo e spesso possono essere necessarie anche 24 ore perché il processo si completi. Poiché vi sono gradienti di temperatura nel materiale, come temperatura del materiale si intende una temperatura media tra la temperatura sul fondo e la temperatura sulla superficie del materiale.
All’inizio della fase del congelamento il materiale si trova alla temperatura dell’ambiente e l’impianto frigorifero comincia a raffreddare le piastre, rapidamente. Al raffreddamento della piastra corrisponde un raffreddamento della soluzione che però è più lento. Si arriva ad un certo punto in cui la soluzione comincia a congelare, per cui la temperatura della soluzione sovraraffreddata sale rapidamente fino al punto di congelamento. Si forma ghiaccio e nel grafico relativo al materiale si registra un “gradino”. Poiché la solidificazione dell’acqua libera calore latente, questo calore latente deve essere sottratto dalle piastre e quindi dall’impianto frigorifero. Questo calore, che è in gran quantità, provoca un leggero rallentamento del raffreddamento della piastra; a questo punto la soluzione interstiziale si sovraraffredda senza formare altro ghiaccio. La piastra riprende a raffreddarsi rapidamente fino a che non arriva alla temperatura prestabilita. La soluzione interstiziale comincia a congelare, con emissione di calore latente a temperatura costante (temperatura di completa solidificazione, Tcs) e il grafico del materiale mostra un secondo gradino. Quando il materiale è completamente solidificato la temperatura tende a equilibrarsi con la temperatura della piastra e quindi scende rapidamente. A questo punto possiamo considerare finito il congelamento, che in genere richiede 45 min–1 ora.
Dopo il congelamento si fa il vuoto nella camera e nel vano condensatore per preparare le condizioni della sublimazione. In fase di essiccamento primario la pressione nell’autoclave, P, deve essere: P@0.3Ps dove Ps è la pressione sulla superficie sublimante. In pratica, il valore della pressione nell’autoclave deve essere 0.1-0.2 torr. Per far avvenire la sublimazione bisogna fornire calore, allora le piastre devono essere riscaldate. La temperatura delle piastre arriva al di sopra della temperatura ambiente (ad es., 35°C). La temperatura del materiale sale perché esso riceve calore dalla piastra, e raggiunge il valore regolato dal sistema di termostatazione, cioè quello della fusione incipiente (Tfi). La Tfi è leggermente superiore alla Tcs, temperatura di completa solidificazione.
L’essiccamento avviene in queste condizioni: temperatura del materiale costante e temperatura della piastra decrescente, se è vero che la resistenza diffusionale del liofilizzato diventa rate–determining. Dopo un tempo relativamente breve comincia a emergere dal ghiaccio il liofilizzato, e allora, Rl gradualmente diventa rate–determining. Il processo viene perciò controllato dal trasferimento di massa (diffusione del vapore). Questo implica che la velocità di essiccamento diminuisca nel tempo e diminuisca anche la temperatura della piastra.
L’essiccamento primario dura molto più tempo del congelamento. Il tempo richiesto dall’essiccamento primario, infatti, è di diverse ore. Si deve osservare, a questo riguardo, che nella Fig. 6 le scale dei tempi delle diverse fasi (congelamento, essiccamento primario, essiccamento secondario) non sono uguali. L’essiccamento primario finisce quando non c’è più ghiaccio che sublima. Allora si osserverà una rapida caduta della velocità di essiccamento. A questo punto, infatti, il liofilizzato contiene solo acqua adsorbita che, alla temperatura a cui abbiamo termostatato il materiale (temperatura di fusione incipiente del materiale congelato (-20°C)) non può desorbirsi alla velocità con cui il ghiaccio sublimava, perché l’energia necessaria è molto maggiore del calore latente di sublimazione. Quindi, quando la sublimazione è finita, la velocità di essiccamento decade e la piastra e il materiale tendono ad assumere la stessa temperatura.
Il monitoraggio della temperatura della piastra e del materiale è importante per verificare che il processo funzioni bene. Un inconveniente, anche se poco probabile, che si può verificare durante l’essiccamento primario è dato dalla fusione del materiale congelato. Comunque, se il materiale congelato fondesse ce ne accorgeremmo dal valore della pressione: se la pressione si mantiene intorno a 0.12-0.15 torr, va bene, se invece essa registra un aumento rapido, allora vuol dire che sta fondendo il congelato in qualche flacone.
Consideriamo adesso le condizioni di essiccamento primario nel caso di termostatazione delle piastre (Tp=cost.). Anche in questo caso, l’ottimizzazione delle proprietà del liofilizzato comporta che il processo sia controllato dal trasferimento di massa. In questo caso, abbiamo già visto, la VE diminuisce nel tempo. Dall’Eq. 2 si vede che, se durante l’essiccamento primario Tp rimane costante, Ts aumenta nel tempo.
Nel caso della termostatazione delle piastre il grafico, a partire dall’essiccamento primario, sarà:
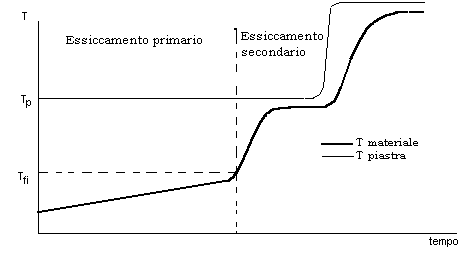
Fig. 7
Fin dall’inizio dell’essiccamento primario, la piastra viene termostatata a una temperatura che rimane costante nel corso di tale essiccamento. Il materiale non deve superare la temperatura di fusione incipiente. Se il materiale ha all’inizio dell’essiccamento primario un valore di temperatura vicino a Tfi, accade che dopo un po’ di tempo il materiale fonde, perché la temperatura del materiale aumenta. Quindi, non si può partire da un valore di temperatura vicino alla Tfi. Le condizioni ideali sono quelle in cui il materiale che sublima raggiunge la Tfi alla fine della sublimazione, cioè, dell’essiccamento primario. Il problema perciò sta nella scelta di Tp, perché è la piastra che fornisce calore. Si devono fare delle prove pilota per le quali si usano liofilizzatori pilota, di piccole dimensioni. Si provano vari valori di Tp e si scelgono quelli che realizzano le condizioni desiderate. Quando si è trovato il valore ottimale di Tp per il liofilizzatore pilota, lo stesso valore si può applicare al liofilizzatore industriale. Infatti, le grandezze importanti del processo non dipendono dal tipo di impianto. Lo spessore e la conducibilità termica dell’intercapedine piastra–flacone, che determinano la resistenza termica di tale intercapedine, sono uguali nel pilota e nell’industriale; la resistenza diffusionale del liofilizzato, Rl,dipende dal materiale e non dall’impianto e quindi, se nell’impianto industriale non ci sono resistenze diffusionali in più rispetto al pilota, una volta ottimizzata la Tp nel pilota tale valore è ottimale anche nell’impianto industriale. Quando è finito l’essiccamento primario, siccome non c’è più ghiaccio, e non c’è più assorbimento di calore latente, la temperatura del materiale sale rapidamente e tende a raggiungere la temperatura della piastra. L’aumento rapido della temperatura del materiale segnala che è finita la sublimazione e comincia il desorbimento. In questo caso è necessario aumentare la temperatura della piastra per far avvenire più rapidamente il desorbimento (v. Fig. 7).
ESSICCAMENTO SECONDARIO (DESORBIMENTO)
Accertata la fine dell’essiccamento primario può cominciare il desorbimento, o essiccamento secondario. Questo processo prevede che il vapore che si sviluppa dal liofilizzato, a velocità molto piccola, sia allontanato dalle pompe da vuoto; perciò l’autoclave non può essere in comunicazione con il condensatore, altrimenti le pompe aspirerebbero anche il vapore proveniente dal ghiaccio sul condensatore. Allora si chiude la valvola a farfalla per isolare l’autoclave (v. Fig.4). Inoltre, il materiale viene portato alla massima temperatura possibile perché la velocità di desorbimento dell’acqua è controllata soprattutto dalla temperatura. In questa fase è il trasferimento di calore ad essere importante. Da studi condotti recentemente si è riscontrato che non è importante andare a valori di vuoto spinto nella fase di essiccamento secondario, perché ciò che determina la velocità del desorbimento è la temperatura del materiale. Si è concluso che la pressione nella autoclave può essere mantenuta agli stessi valori che aveva durante l’essiccamento primario (0.1-0.2 torr è una pressione sufficientemente bassa da non ostacolare il percorso del vapore che si sviluppa nel desorbimento).
Abbiamo visto che nell’essiccamento secondario non conviene portare la pressione a valori troppo bassi. Vediamo per quale ragione. Se è molto bassa la pressione nell’autoclave, è molto bassa anche la pressione all’interno dei pori del liofilizzato. Se è così, allora sarà molto bassa la conducibilità termica del liofilizzato (che di per sè, essendo materiale organico, ha conducibilità bassa). Per far avvenire il desorbimento il liofilizzato deve essere riscaldato ad una temperatura appropriata e siccome il calore si trasferisce per conduzione dalla piastra al liofilizzato, allora, per un certo valore di Tp, la temperatura alla superficie del liofilizzato è molto più bassa di Tp se la conducibilità termica del liofilizzato è molto bassa. Quindi in generale non conviene che la pressione all’interno dei pori sia troppo bassa. Dati sperimentali hanno dimostrato che il grado di vuoto nell’essiccamento secondario dovrebbe essere simile a quello dell’essiccamento primario.
Durante l’essiccamento secondario si deve escludere la camera dal condensatore, perché il ghiaccio depositato sul condensatore genererebbe una pressione parziale di vapore che ostacolerebbe il desorbimento. Secondo consuetudine, nell’essiccamento secondario viene fatto un vuoto estremamente spinto per allontanare le molecole di acqua adsorbite. Questo, molto spesso è irragionevole. E’ necessario solo se si vuole un grado di secchezza nella autoclave molto elevato, ad es., se il materiale è molto igroscopico.
In teoria, l’essiccamento secondario non finisce mai, perché una traccia di acqua nel materiale rimane sempre. Si deve stabilire perciò quanta è l’acqua tollerata nel materiale. Per esempio, si può stabilire che il materiale liofilizzato deve avere un contenuto di acqua inferiore all’1%. Si fanno delle prove stabilendo valori di temperatura, pressione e tempo che consentono di ottenere i requisiti voluti.
Fonte: http://omero.farm.unipi.it/matdidFarm/62/Metodologie-Liofilizzazione.doc
Sito web da visitare: http://omero.farm.unipi.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve