I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
SISTEMA IMMUNITARIO
L’omeostasi è il mantenimento delle condizioni chimiche, metaboliche, fisiche, costanti. Noi siamo continuamente sollecitati dall’ambiente, con cui siamo in un rapporto di non-equilibrio, poiché siamo in un sistema aperto cioè, scambiamo materia ed energia con l’ambiente); manteniamo al nostro interno una condizione completamente diversa da quella che c’è fuori: proprio per questo siamo instabili. L’equilibrio lo raggiungiamo solo con la morte. Questo vale anche per la singola cellula (che ha il citoplasma nettamente diverso dall’ambiente in cui è immersa) bisogna mantenere costanti queste caratteristiche, ma l’organismo fa fatica a stabilizzare questo non-equilibrio. Un esempio di ciò è la temperatura (tendenzialmente la nostra temperatura interna è di 36-37° C): il brivido, che è il tentativo del corpo di far risalire temperatura corporea che per qualche ragione si è abbassata, è una contrazione dei muscoli erettori del pelo che crea calore, serve per ripristinare il non-equilibrio termico minato da un abbassamento di temperatura. Viceversa, se la temperatura interna sale, noi sudiamo. Sudare, cioè ricoprirsi di un velo d’acqua, raffredda il sistema perché evaporano le molecole d’acqua con energia cinetica maggiore, quindi quello che rimane è una media più bassa, e la temperatura diminuisce.
Questi meccanismi omeostatici si innescano per mantenere costanti le condizioni di non-equilibrio ( condizione interna ≠ da quella interna)
Oltre a subire le angherie dell’ambiente, noi subiamo anche l’attacco di agenti patogeni che minano l’equilibrio. Noi abbiamo una barriera che ci protegge dall’esterno, costituita da pelle (all’esterno) e mucose (all’interno, detta anche “pelle umida”). Entrambe sono costituite superficialmente da strati di cellule morte.
Ci sono anche barriere chimiche e funzionali (es. tonsille, linfonodi, appendice a proposito di quest’ultima, l’appendice fa più danni che benefici, ma non può sparire di getto improvvisamente, deve sparire gradualmente, ma più è piccola, più è facilmente infiammabile, quindi la selezione naturale ha mantenuto appendici più grandi).
Queste barriere chimiche sono organi, o strutture, che si attivano quando entrano agenti esterni: sono barriere funzionali. Tuttavia queste non sono invincibili, certe volte vengono superate, ed entrano in azione i nostri agenti immunitari.
Facoltà fondamentale del sisitema immunitario è quella di distinguere tra le proprie cellule e molecole, (SELF) e cellule o molecole estranee (NOT-SELF) Vedremo in seguito come si esplica questa capacità.
Il nostro sistema immunitario può essere:
Il sistema immunitario innato aspecifico è quello che noi tutti abbiamo, non cambia nel corso della vita: chi ce l’ha più efficiente si ammala meno. Non è esclusivo dell’uomo, infatti è molto antico: ce l’hanno le mosche, le stelle marine, i vermi nematodi e pure le piante...
Il sistema immunitario adattivo specifico impara nel corso della vita, si ammaestra.
Una curiosa teoria spiega come le migliori condizioni igieniche, i progressi in campo farmaceutico e i vari vaccini a cui siamo sottoposti fin da piccoli, hanno reso i nostri sistemi immunitari disoccupati, che quindi finiscono per inventarsi patogeni: secondo alcuni nascono di qua le allergie.
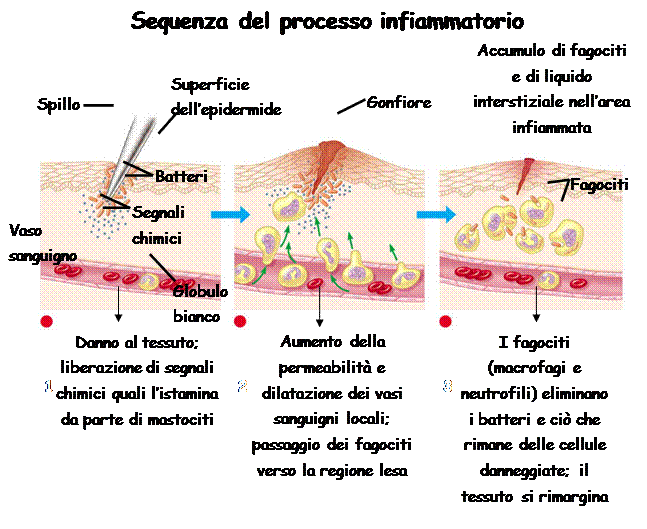
Ad esempio in una ferita. Immediatamente si aziona il sistema immunitario innato aspecifico. Questa risposta si chiama infiammazione (la ferita manifesta tumor, dolor, rubor, calor: è gonfia, dolorante, arrossata e calda). Dopodichè è possibile che questo primo atto di difesa riesca ad uccidere tutti i patogeni, la ferita si rimargina e tutto finisce così, quindi l’infiammazione può guarire l’attacco dei patogeni. Altre volte invece non basta: se il patogeno supera la barriere del sistema immunitario innato, entra in azione il sistema immunitario adattivo, che è più lento, ma se il patogeno non è troppo rapido e aggressivo, riesce a debellarlo. Aggressivo significa che si replica troppo velocemente: in questo caso l’antibiotico permette di frenare la replicazione rallentando l’effetto del patogeno: in questo modo il sistema immunitario adattivo specifico ha il tempo di eliminare il patogeno. Si distinguono due tipi di infiammazione: ACUTA (ANGIOFLOGOSI) di breve durata caratterizzata dalla comparsa di essudato composto da liquidi, proteine plasmatiche (edema) e dalla migrazione di leucociti spt neutrofili. CRONICA (ISTOFLOGOSI) di lunga durata con presenza di macrofagi, proliferazione di vasi sanguigni da fibrosi e necrosi tissutale.

Cellule del sangue
Ci sono i globuli bianchi, detti anche leucociti e le piastrine.
I leucociti sono cellule nucleate grosse, e possono essere:
I monociti e i linfociti non sono granulosi, hanno il citoplasma non granulare, mentre i granulociti hanno un citoplasma tutto puntinato.
I monociti sono in grado di uscire dal sangue e trasformarsi in macrofagi, che stanno nei tessuti interstiziali, tramite un processo detto diapedesi: il vaso capillare è rivestito da cellule piatte (endotelio parete dei capillari), tra le quali ci possono essere delle fessure attraverso cui passano i monociti. Il monocito quindi, si schiaccia ed esce, cambiando nome in macrofago ed acquistando la capacità di fagocitare ciò che reputa non appartenente all’uomo (not-self) o frammenti di cellule proprie, morte per apoptosi o necrosi.
I linfociti svolgono una difesa mirata contro il not-self
, sono specifici per ogni tipo di patogeno, e sono di due tipi:
I granulociti sono di tre tipi:
Esiste una formula leucocitaria che indica in percentuali quanti globuli bianchi ci sono nel sangue. I neutrofili sono i più numerosi (55-70%); gli acidofili invece sono il 2-3% e i basofili sono ancora meno (0,5-1%). I linfociti sono intorno al 20-30% mentre i monociti sono 3-8%.
Questi parametri non sono unici, ma presentano variazioni (come ad esempio i neutrofili che variano dal 55% al 70%) proprio perché sono continuamente sollecitati: è quindi possibile che sforino da questi parametri, l’importante è che non sforino troppo. In tutto i globuli bianchi presenti nel nostro sangue sono da 5000 a 9000/mm3. I globuli rossi sono molti di più: circa 5 milioni/mm3; le piastrine sono circa 300.000/mm3.
Cellule nei tessuti fuori dai vasi sanguigni
Normalmente i patogeni finiscono nei tessuti interstiziali. Le cellule immunitarie presenti in questi distretto sono:
Molecole del sistema immunitario
- citochine
Le citochine sono piccole proteine secretorie che regolano l’immunità , l’infiammazione e l’emopoiesi. Sono prodotte ex novo come risposta ad uno stimolo immune e, generalmente, agiscono a corto raggio, per brevi periodi e a bassa concentrazione. Agiscono legando specifici recettori di membrana tirosinchinasici e attivando la successiva trasduzione del segnale attraverso secondi messaggeri il cui atto finale è l’attivazione di uno specifico set di geni. La risposta alle citochine include un aumento o diminuzione nell’espressione di proteine di membrana (compresi i recettori delle citochine), la proliferazione cellulare e la secrezione di molecole effettrici.
Citochina è un termine generale; nomi più specifici includono linfochine (citochine prodotte da linfociti), monochine (citochine prodotte da monociti), chemochine (citochine con attività chemiotattica), interleuchine (citochine prodotte da leucociti che agiscono su altri linfociti). Le citochine possono agire sulle stesse cellule che le producono (attività autocrina), sulle cellule circostanti (attività paracrina) o, in alcuni casi, a distanza (attività endocrina) (Fig. 1). E’ una condizione abbastanza comune a cellule di tipo diverso secernere la
stessa citochina o per una singola citochine avere piu’ cellule bersaglio (pleiotropia). Le citochine presentano un’attività ridondante, il che significa che la stessa attività cellulare puo’ essere stimolata da citochine diverse. Le citochine sono un insieme di proteine secrete da diverse cellule, fondamentalmente dal sistema immunitario, come risposta ad uno stimolo immunologico o come segnale intercellulare dopo lo stimolo di una di esse.
Oltre alle citochine troviamo altre molecole importanti nel mediare la risposta immunitaria:
Citochine, complemento e anticorpi sono tutte molecole circolanti, cioè funzionano da primi messaggeri: sono emessi da una cellula, diretti ad altre cellule. Gli antigeni, invece, sono fisse sulle membrane.
Il sistema del complemento è costituito da un gruppo di proteine, principalmente enzimi, presenti nel sangue ed in grado di interagire con il complesso antigene-anticorpo provocandone la lisi. Ad oggi è noto che il sistema del complemento è costituito da 18 differenti proteine indicate utilizzando la lettera maiuscola C seguita da un numero (C1, C2, C3, ecc.) oppure utilizzando altre lettere.
Gli anticorpi sono molecole prodotte dai linfociti B di cui si parlerà più avanti
Gli antigeni sono invece tutte le molecole in grado di scatenare una risposta immunitaria. A volte il termine antigene viene anche utilizzato per indicare l’intero patogeno come un virus o un batterio.
Nella prima fase si attiva la difesa aspecifica Questa si realizza quando il patogeno supera le barriere (costituite da pelle, mucose e dalle zone linfatiche). I primi a muoversi sono i neutrofili; la possibilità che il patogeno incontri un neutrofili è molto alta (visto il numero enorme di questi al nostro interno) e in questo modo viene fagocitato da uno di essi. Naturalmente il patogeno deve prima essere riconosciuto e catturato per poter essere fagocitato. L’aggancio è reso possibile dai recettori di membrana chiamati TLR (Tool Like Receptor) presenti su macrofagi, cellule dendritiche e neutrofili. Questi sono i sistemi di ancoraggio capaci di riconoscere e legare molecole specifiche e importanti per la vita dei patogeni. Tale legame determina una modifica del comportamento sia del patogeno, sia del neutrofili (o del macrofago, visto che hanno la stessa funzione). Il patogeno diventa ligando, si lega al TLR e fa iniziare la trasduzione del segnale, che termina con l’attivazione dei geni nel nucleo, geni che andranno a sintetizzare le interleuchine (molecole segnale per i globuli bianchi: inter leucos) e ad attivare il processo di fagocitosi. Tuttavia i geni non andranno a produrre una sola citochina, ma inizieranno a sintetizzare un gruppo che ha la funzione di chiamare a sé altri macrofagi o neutrofili.
Il meccanismo di fagocitosi è molto importante perché toglie qualunque porcheria: elimina qualunque cosa entri nell’organismo. Qui a fianco si vede un macrofago che sta emettendo pseudopodi (prolungamenti) per prendere contatto e poi fagocitare batteri sferoidali detti cocchi. Mentre i macrofagi fagocitano tutto ciò che riconoscono come not-self, altri granulociti (i basofili) liberano l’istamina e l’eparina, per permettere la fuoriuscita dai capillari di tutte queste cellule (infatti l’istamina vaso-dilata allargando le fenestrature dell’endotelio e l’eparina fa in modo che il sangue non coaguli). Ciò genera un aumento di temperatura: siamo nel pieno dell’infiammazione.
I globuli bianchi lavorano per distruggere tutto: certe volte basta il loro intervento. Tuttavia è meglio fare una precisazione: il patogeno non viene proprio distrutto, viene smontato nel citoplasma del macrofago. Alcune sue molecole vengono trasportate verso la superficie e vengono mostrate all’interno complesso proteico presente sulla membrana dei macrofagi: l’MHC (complesso maggiore di istocompatibilità). Questo, come delle mani, presenta l’antigene. L’MHC, però, non è mai vuoto: se non contiene il patogeno, contiene comunque il prodotto del metabolismo cellulare (mostra sempre qualcosa!). Solo in alcuni tumori esso non c’è perché sprofonda. Gli MHC sono sempre monitorati dai linfociti T. Non solo i macrofagi, ma tutte le cellule hanno l’MHC, e tutti devono rendere conto delle proprie attività metaboliche, rinnovando almeno ogni 8h il contenuto dei propri MHC. (in accordo con le esigenze di trasparenza ...)
Gli MHC sono di due tipi:
Nella specie umana gli MHC sono anche detti HLA (human leucocyte antigen): sono delle proteine di membrana i cui geni stanno sul braccio corto del sesto cromosoma.
Se alla fine di questa fase non ci sono più batteri, la situazione è risolta; ma se questi patogeni si sono riprodotti, bisogna mettere in atto le difese specifiche. Queste si innescano quando un linfocita T-helper, localizzato in un linfonodo viene in contatto con una APC (che nel frattempo è stata presa, drenata dal liquido interstiziale ed è arrivata ai linfonodi, nel cui stroma scorre lentamente la linfa che contiene i linfociti capaci di “processare” le APC).
I linfociti T hanno dei recettori superficiali detti TCR. Questi servono per riconoscere MHC di II classe dei nostri APC, costruiti in modo tale per incastrarsi. Ma i linfociti T non sono tutti uguali, poiché i TCR sono diversi l’uno dall’altro: hanno una parte fissa e una variabile. Quella fissa è complementare all’MHC, mentre la parte variabile deve legarsi al contenuto dell’MHC ma solo quando questo è un not-self.
Quando ciò succede (e succede per forza: abbiamo già pronto un linfocita adatto per ogni MHC + antigene) , si attivano una serie di meccanismi a cascata. Il linfocita T, una volta legato, produce delle molecole dette interleuchine. Per la precisione il linfocita Th produce interleuchina 2 ma per farlo necessita dell’interleuchina 1, prodotta dall’APC dopo che si è realizzato il legame tra MHC e TCR, che funziona da attivatore del processo. L’interleuchina 2 ha vari bersagli: innanzitutto il linfocita T stesso (infatti è una stimolazione autocrina), che si divide per formare un clone (per farlo si duplica più volte); ma ha anche altri bersagli: altri linfociti T, detti citotossici (LTc) o T Killer.
Questi sono simili agli helper, ma sono attivabili solo se hanno a loro volta legato lo stesso antigene: questo lo sanno riconoscere anche se non è legato all’APC in quanto possono riconoscere antigeni esposti su MHC di I classe, presenti su tutte le cellule del nostro corpo, grazie a un cofattore chiamato CD8. I linfociti citotossici sono utili per distruggere le cellule infettate da virus e/o batteri o cellule cancerose, poiché distruggono qualunque cellula presenti antigeni frutto di un metabolismo alterato. Hanno quindi la funzione di uccidere, tuttavia non bisogna confonderli con i linfociti Natural killer, detti più comunemente NK. Le NK essenzialmente hanno un ruolo nell'immunità antitumorale, eliminano le cellule tumorali autologhe, allogeniche e anche xenogeniche, indipendentemente dal fatto che questi bersagli esprimano il MHC; anzi esse eliminano preferenzialmente le cellule bersaglio che esprimono poco o nulla l’ MHC di classe I, meccanismo spesso attuato dalle cellule tumorali per sfuggire all'azione del sistema immunitario. Le NK hanno però i cosiddetti recettori inibitori delle cellule killer (Killer cell Inhibitory Receptors, KIR. Mentre l'interazione del MHC con il TCR presente sulla membrana delle cellule T conduce all'attivazione della cellula T, l'interazione del MHC con i KIR porta all'inibizione dell'attività NK che rimangono inattivi se vi è riconoscimento dell'MHC I, quando l'MHC I non viene rilevato sulla cellula si ha così l'attivazione di processi che portano alla lisi della cellula bersaglio.
Ci sono due tipi di linfociti T-helper:
Nonostante le diverse funzioni, entrambi i tipi di linfociti T-helper presentano la stessa struttura: hanno un TCR affiancato dal recettore CD4. Quest’ultimo è un co-recettore senza cui il TCR non funzionerebbe, ed è sempre uguale, è costante, mentre il TCR è la parte variabile che distingue un linfocita T da un altro linfocita T.
I linfociti T citotossici sono anche detti CD8, poiché questo è il loro co-recettore. I corecettori servono per fortificare l’aggancio tra il linfocita T e l’altra cellula. Questa è un’APC per i linfociti T helper, mentre per i citotossici può essere un’APC ma non solo, nel senso che riconosce sempre l’antigene associato al MHC di I classe (che quindi può stare su un’APC, ma anche su tutte le cellule è importantissimo il fatto che il LTc può riconoscere l’antigene su qualunque cellula).
Come già detto, se il linfocita T citotossico aggancia qualcosa di anomalo, deve aspettare un comando che poi porterà alla attivazione del LTc e alla distruzione del patogeno. Infatti, quando il linfocita T citotossico lega l’antigene, butta fuori i recettori per l’interleuchina 2, e aspetta che il Th abbia legato lo stesso patogeno. Quando questo accade il Th libera interleukina 2 che verrà captata da quei linfociti che hanno già legato lo stesso patogeno, è il segnale per il linfocita T citotossico, che ora può uccidere la cellula liberando
la perforina, una proteina che perfora la membrana cellulare provocandone la morte.
Nella figura sottostante sono rappresentate le cellule e le principali molecole coinvolte nella risposta specifica
Fino a questo momento, abbiamo sempre parlato di difesa cellulare. Ma, come detto precedentemente (con la distinzione dei Th1 e Th2) esiste anche una difesa umorale.
Questa è mediata da anticorpi, che sono delle molecole proteiche secrete dai linfociti B i quali possono fungere da APC, presentando l’antigene nel MHC ( possiede sia MHC I che MHC II) e legarsi in questo modo ai linfociti T).
I linfociti B sono simili ai linfociti T, e come loro devono essere attivati. Vengono attivati dall’interleuchina 4, che attiva solo quei LB che a loro volta hanno legato l’antigene (cioè quando stiamo subendo un’infezione). Il linfocita B aggancia l’antigene attraverso un recettore di membrana che è l’anticorpo (diverso dai recettori del linfocita T perché questo non è soggetto a restrizione MHC: è quindi capace di legare e riconoscere l’antigene da solo, cioè non associato a MHC.
L’anticorpo si adatta all’antigene, ma per attivare il LB serve l’attivazione dei linfociti T-helper. Dopo aver agganciato l’antigene, i linfociti B esibiscono sulla membrana i recettori per le interleuchine 4, prodotte dai linfociti T-helper, il cui legame innesca la trasduzione del segnale che porterà all’attivazione del LB.
Quindi, ricapitolando, i punti fondamentali sono tre:
La trasduzione ha come effetto quello di far duplicare più volte il linfociti B, che forma un clone, in cui tutti i linfociti B derivati presentano lo stesso anticorpo (si è risvegliata la capacità di duplicazione). Una volta formato il clone, questi linfociti B secernono gli anticorpi, che si staccano dalla membrana e vanno nel sangue. Una parte di questi linfociti B maturati e secernenti si chiamano anche plasmacellule. Queste sono più grosse rispetto ai linfociti B e hanno un citoplasma molto irregolare poiché sono ricchi di reticolo endoplasmatico rugoso (ci sono più ribosomi, quindi più anticorpi visto che questi sono molecole proteiche). Alcune plasmacellule diventeranno cellule di memoria, che sono cellule eterne, vivono quanto noi; rappresentano una scorta di cellule che conservano la memoria dell’avvenuto contatto con gli antigeni. Sono quiescenti, ma pronte ad attivarsi all’occorrenza: se si ripresenta un antigene già debellato precedentemente, immediatamente si attivano duplicandosi e rilasciando anticorpi, così velocemente che non si manifesta più la malattia.
Ma gli anticorpi cosa sono?
L’anticorpo è una proteina quaternaria: è formata da più catene polipeptidiche derivate da geni diversi. È formato da due catene pesanti e due catene leggere, tenute insieme da ponti di solfuro ( legami chimici tra amminoacidi che contengono zolfo, come ad esempio la cisteina). Entrambe le catene hanno una parte costante, che non cambia, e una variabile, che è quella che si lega all’antigene. Le parti NH2 terminali, sono associate nel creare attraverso una struttura terziaria, il sito attivo dell’anticorpo.
Presi degli anticorpi, e trattati con alcune proteasi (cioè degli enzimi come la papaina che digeriscono le proteine: si usano per purificare il DNA) si ottiene un frammento cristallizzabile FC e due FAB (frammento che si lega all’antigene). Gli anticorpi sono piantati sui linfociti per mezzo dello stelo, cioè l’FC.
Ci sono altre proteasi che rompono l’anticorpo longitudinalmente (pepsina)
La molecola di anticorpo è prodotta a partire da geni diversi:
Esistono 5 famiglie di geni C, che corrispondono alle 5 famiglie di anticorpi, mentre vi è un numero più elevato di geni V.
Gli anticorpi appartengono, insieme ai TCR e ai MHC di I e II classe, alla famiglia delle immunoglobuline. Gli anticorpi, a loro volta, si dividono in 5 categorie (riferite alle catene pesanti): IgA, IgG, IgM, IgD, IgE.
I siti variabili derivano da geni V, che sono continuamente rimaneggiati: si verifica un’ipermutazione somatica (livello altissimo di variabilità dei geni V). Durante le maturazioni di queste proteine, avvengono un enorme numero di rimaneggiamenti, tanto che ricombinandoli in modi diversi si possono ottenere circa 18 miliardi di parti variabili diversi (quindi qualunque anticorpo può riconoscere qualunque antigene).
Ritornando alle parti costanti, bisogna analizzare ogni tipo di anticorpo.
Le IgM sono le prime che compaiono nella vita embrionale, e sono i primi anticorpi prodotti dalla risposta umorale. Sono i più antichi dal punto di vista filogenetico. Sono fatti a Y. I linfociti B “naif” hanno sulla loro membrana tutte le IgM. Quando un linfocita B viene a contatto con un antigene, produce anticorpi IgM, tuttavia, successivamente matura ulteriormente (avviene quello comunemente conosciuto come cambiamento o commutazione di classe). Con questo processo inizia a produrre IgG: gli anticorpi che sta costruendo hanno una catena pesante diversa. Quando questi stanno sulla membrana, non c’è differenza dagli altri; ma quando le IgG si liberano, la differenza con le IgM salta subito all’occhio.
Le IgM si liberano a gruppi di 5: sono pentameriche. Infatti possono inglobare l’antigene al loro interno o possono unire più antigeni insieme
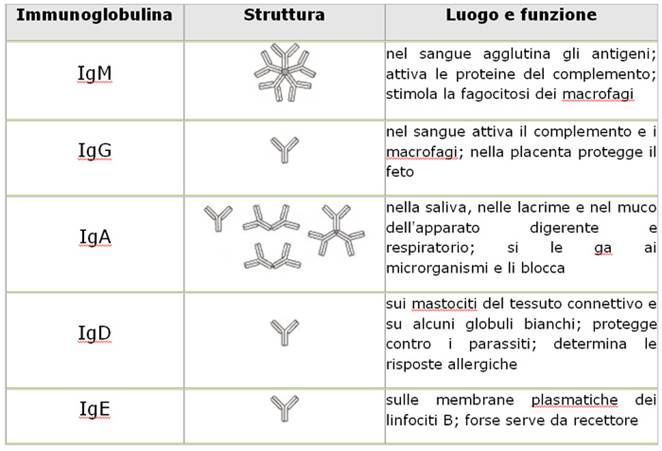
Una volta che si ha l’IgG, queste quando vengono liberate sono monomeriche: sono più snelle, più veloci e più efficaci, lavorando singolarmente.
Le IgA, invece, sono prodotte in circostanze e luoghi particolari: sono concentrate in liquidi più a contatto con l’ambiente esterno (cioè lacrime, latte materno, saliva). Sono dimeriche.
Le IgD sono nel sangue, ma si ignora la loro specificità, non si sa bene cosa facciano. Sono di solito insieme alle IgM (nel 70% dei casi; hanno simile la parte variabile). Spesso non vengono neanche liberate, rimangono sulla membrana (forse sono coinvolte nella trasduzione del segnale).
Le IgE sono quelle che si fissano con la catena costante sulle membrane delle mastcellule ( cellule del sistema reticolo-istiocitario, si trovano principalmente sulle pareti dei vasi sanguigni, contengono istamina). Al primo contatto con l’antigene, le IgE si liberano andandosi a fissare sulle membrane delle mastcellule, alla seconda esposizione, legano l’antigene con la parte variabile e in tal modo operano la trsduzione del segnale che si traduce in una liberazione massiccia di istamina che vasodilata e richiama macrofagi attivando il processo infiammatorio. Sono le immunoglobuline responsabili dei disordini allergici nei confronti dei quali si capisce meglio ora l’efficacia di un “antistaminico”, il quale è ovvio che cura i sintomi e non le cause.
Le 5 famiglie di immunoglobuline si distinguono per a tipologia della catena pesante (cioè lo stelo).
Ora, riprendendo un discorso già fatto, una volta che il linfocita B lega l’antigene, va nei linfonodi per legarsi ai linfociti T. Qua il linfocita B internalizza, digerisce ed espone l’antigene come un’APC. Una volta legato al linfocita T, questo produce citochine, in particolare, produce l’interleuchina 4, per la quale il linfocita B ha già esposto i recettori. Quando lega l’interleuchina 4, forma un clone; dopo di che diventa plasmacellula e le IgM si staccano dalla superficie. Durate la sua vita, la plasmacellula cambia anticorpi, producendo IgG. In questa fase si verificano mutazioni puntiformi nei geni responsabili della parte variabile (ed è questo il fenomeno chiamato ipermutazione somatica). Ciò si verifica durante la fase di clonaggio del linfocita B. a ogni duplicazione ci sono queste mutazioni, quindi il clone di linfociti B maturi conterrà anticorpi che sapranno legare meglio o peggio l’antigene (questo per migliorare ulteriormente la risposta immunitaria). Quelli che sapranno legare meglio gli antigeni verranno selezionati positivamente in un secondo passaggio nei linfonodi, luoghi nei quali i LB ritornano periodicamente durante la risposta immunitaria.
Dopo il cambiamento di classe, le IgG agganciano l’antigene, andando a finire nell’ultima fase della risposta immunitaria. Gli anticorpi possono attaccarsi ai virus, impedendo loro di entrare nelle cellule [il virus, per infettare una cellula, deve avere delle sedi di ancoraggio (per questo un virus vegetale non ci spaventa; non potendo trovare ancoraggi su cellule animali, non è dannoso)].
Gli anticorpi possono attaccarsi anche a batteri, comportandosi da opsonine (richiami chimici: le catene costanti fungono da antenne da richiamo per i macrofagi). I batteri si appiccicano gli uni agli altri, formando dei grumi segnale d’attacco per i macrofagi.
Talvolta gli antigeni sono semplici molecole come ad esempio le tossine (la patogenicità di un batterio sta nell’emettere tossine). L’anticorpo è capace di legarsi a queste molecole circolanti (le tossine); queste vengono legate all’anticorpo e precipitano: se l’antigene precipita, viene immediatamente fagocitato dai macrofagi.
Infine gli anticorpi possono attivare le proteine di complemento: queste sono delle proteine seriche, cioè, stanno nel siero.
[sangue – proteine ematiche
plasma – proteine plasmatiche è sangue privo di cellule, di colore giallognolo, non rosso
siero – proteine seriche è la parte liquida del sangue, è plasma senza fibrogeno (una delle proteine responsabili della coagulazione del sangue)
il liquido extra-celullare è ancora diverso: deriva dal sangue e si forma nel distretto capillare a causa di uno squilibrio tra pressione idrostatica e pressione oncotica, a favore della prima]
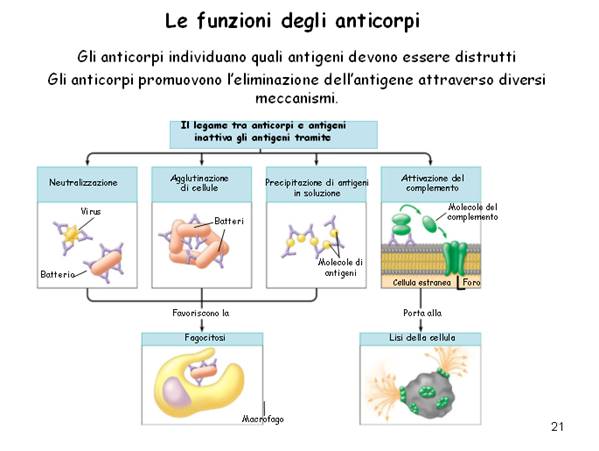
Il complemento è una serie di proteine che intervengono sia nella fase infiammatoria che nell’atto finale della difesa immunitaria, legandosi una dopo l’altra, formando dei grovigli sugli steli degli anticorpi (che devono essere almeno due) fissati su una cellula che deve essere distrutta. Si arriva così alla lisi cellulare. Una volta liberata, ciò che resta della cellula viene fagocitato dai macrofagi.
Per farlo lavorare efficacemente, il nostro sistema immunitario necessita di un’alta temperatura, intorno ai 38-39°C (quindi se non supera i 40°C è meglio non farla abbassare. Per l’influenza è inutile prendere antibiotici perché è una malattia virale: è molto meglio prendere vitamine B.
Selezione clonale: seleziona un clone. È il meccanismo con cui noi rispondiamo con produzione di anticorpi specifici per ogni antigene. Ma come si fa ad avere un anticorpo pronto per ogni antigene?
Inizialmente si pensava che, appena entrato l’antigene, il corpo costruisse un anticorpo su misura, ma in realtà non è così. Il nostro corpo, infatti, possiede già qualunque tipo di anticorpo. Involontariamente l’antigene seleziona un anticorpo che già esiste: non viene preparato al momento, può al massimo essere migliorato durante la duplicazione dei linf B. A seguito della selezione clonale viene prodotto un clone di linfociti che producono lo stesso anticorpo.
Delezione clonale: è alla base del meccanismo che realizza il riconoscimento del self dal not-self all’interno dell’organismo e si attua durante la vita embrionale. Ma come si realizza dal momento che l’embrione non ha competenza immunitaria? L’embrione impara a distinguere il self dal not-self attraverso la delezione clonale. I linfociti e tutte le cellule del sangue sono prodotti a partire dalla cellula staminale ematopoietica (che sta nel rachide, nello sterno e nelle anche, in cui c’è il midollo rosso). È una cellula multipotente (produce più tipi cellulari ma tutti appartenenti alla famiglia ematica leucociti, emazie ecc). Questa staminale matura, dà origine a due tipi di staminali che però hanno perso un po’ della loro funzionalità: la linea linfoide e la linea mieloide. Quelle della linea linfoide iniziano il processo di maturazione per linfociti B e linfociti T, che consiste in una selezione che elimina linfociti con recettori incapaci di riconoscere MHC e anche tutti i linfociti che riconoscono l’MHC quando questo contiene molecole self (che innescherebbero la reazione immunitaria contro le nostre stesse molecole). Rimangono, invece, i linfociti che riconoscono malamente MHC contenenti self e che quindi non si attaccano ad essi (non vengono eliminati perché non sono dannosi) ma potranno legarsi in maniera più salda agli stessi MHC contenenti un not-self.
La linea mieloide, invece, è la progenitrice di transito dei globuli rossi, delle piastrine e dei granulociti.
La prima delezione clonale si ha nell’embrione. La delezione clonale, in generale, non sempre funziona bene: in questo caso si manifestano le malattie autoimmuni. Queste malattie aumentano sempre di più oggigiorno, non solo per questioni igieniche, ma anche per cosa mangiamo e per cosa respiriamo.
Quando le plasmacellule operano la commutazione di classe, dopo le IgG possono produrre anche IgA (ma non sempre e non ovunque) e IgE, per sostenere la fase infiammatoria difesa aspecifica.
Le IgE si fissano sulla membrana delle mastcellule con la catena pesante. Quando poi arriverà di nuovo l’antigene, si aggancerà all’IgE che, essendo legate alle mastcellule, trasdurrano il segnale finalizzato alla liberazione di istamina ed eparina, e la mastcellula libererà anche TNF. Se tutto questo si mette in moto per un polline, allora vi è un’intensa liberazione d’istamina, eparina e TNF che richiamerà macrofagi che non sanno cosa mangiare. Le vie respiratorie, nelle allergie da polline, s’intasano per un pericolo immaginario. Sono le IgE a confondersi, prendendo per patogeno una cosa che non lo è. Conseguenza: raffreddore cronico.
Shock anafilattico: situazione parossistica che succede con un’ipersensibilità nei confronti di sostanze che per la maggior parte delle persone sono quasi innocue, tra cui quelle preseti nel pungiglione delle api o delle vespe. Lo shock anafilattico altera all’istante tutti i meccanismi omeostatici; letteralmente significa “iper protezione”. È la forma più grave di anafilassi (iperprotezione): la molecola viene scambiata per qualcosa di totalmente dannoso (allergene), ma ciò non succede alla prima puntura, ma solo alla seconda, dove l’antigene si lega alle IgE delle mastcellule, che liberano dosi massicce di istamina, entrando in circolo reazione sistemica di tutto il corpo. L’istamina produce una vasodilatazione generale, che porta ad una diminuzione della pressione del sangue; conseguenza: collasso. Il sintomo principale è lo svenimento: se non s’interviene subito si rischia la morte. La persona, anche per allergie al polline, fatica a respirare per bronco-spasmo. Chi sa di avere queste allergie, è meglio che giri con siringhe di adrenalina(epinefrina) (meglio se iniettata direttamente nel cuore). L’adrenalina provoca vaso-costrizione (chiude i vasi) e bronco-dilatazione (apre i bronchi). Non ci sono cure per le allergie, ma solo vaccini che però non funzionano su tutti.
L’ultima parte della catena pesante (COOH terminale) delle immunoglobuline, corrisponde ad una sequenza nucleotidica che può essere trattata come un esone o come un introne. L’ultima parte dei geni per la catena pesante è una porzione che codifica per amminoacidi idrofobi o idrofili.
Se quest’ultimo frammento genico è trattato come se fosse un esone, la catena pesante terminerà con amminoacidi idrofobi, quindi potrà rimanere nello strato fosfolipidico della membrana.
Se invece è trattato come un introne (quindi niente traduzione in sequenza amminoacidica), la parte terminale sarà fatta da amminoacidi idrofili, e quindi non riuscirà a stare sulla membrana.
Questo discorso serve perché quando il linfocita B è naif, l’IgM non viene rilasciata, mentre quando è plasmacellula, viene rilasciata. Di conseguenza, tutti gli anticorpi circolanti hanno la parte terminale della catena pesante idrofila, mentre gli a.c. fissati sulla membrana cellulare presentano l’estremità della catena pesante idrofoba; (le IgD, che non sono circolanti, hanno la parte terminale della catena pesante idrofoba, per cui possono rimanere piantati ai linfociti).
In generale, le loro cause prime sono mutazioni genetiche provocate da fattori esterni, interni o ereditari. Esse possono essere di due tipi:
Per quanto riguarda le malattie autoimmuni organo specifiche abbiamo:
Il pancreas è nella parte centro-sinistra dell’addome, si inserisce nell’ansa del duodeno. È una ghiandola mista perché in parte esocrina e in parte endocrina.
Nella parte esocrina, è una ghiandola che partecipa alla digestione, emettendo nel duodeno succhi digestivi. Le cellule β del pancreas, invece, sono la parte endocrina del sangue, e possono produrre insulina che è un ormone, che quindi viene immesso nel sangue per abbassare la glicemia, cioè il livello di zuccheri nel sangue. Il diabetico ha degli anticorpi che attaccano le cellule β, che quindi non producono più insulina. Il livello ematico altro provoca la glicemia e avere livelli alti di zuccheri portano affaticamento renale (del rene, che non raccoglie più gli zuccheri dell’urina e quindi rimane urina dolce i reni devono fare un iperlavoro per tentare di assorbirlo tutto, ma non riescono e quindi si danneggiano) e problemi a livello sistemico. Il tasso di glucosio nel sangue è, quindi, elevato e contemporaneamente non è a disposizione delle cellule. Un diabete primario non è compatibile con la vita: i metabolismi vengono alterati. L’insulina in commercio è prodotta da batteri e lieviti. INSULINA LYS-PRO vedere libro Milanesi.
Non esistono alcune cure per risolvere malattie autoimmuni, ma si possono solo controllare.
Per quanto riguarda le malattie autoimmuni sistemiche, abbiamo:
Quindi, se gli assoni sono mielinizzati, di conseguenza lo sono anche le fibre (e proprio per questo appaiono di colore bianco-giallognolo); sono proprio le fibre, mielinizzate, a condurre molto velocemente lo stimolo. Quindi, se gli anticorpi colpiscono la mielina, chi ne risente è proprio il motoneurone, perché senza questo rivestimento degenera fino alla morte: la fibra muscolare non riceve più il segnale e nel paziente, progressivamente, i muscoli si atrofizzano fino alla paralisi. Il problema maggiore è che la respirazione avviene grazie ai muscoli intercostali: con questa malattia la cassa toracica non si dilata più e il paziente smette di respirare (può vivere solo attaccato alle macchine, le capacità intellettive non vengono danneggiate).
È invece una cosa completamente diversa il tira-nervo: è una contrattura muscolare localizzata; da segnali di contrazione in maniera costante (il muscolo ha sempre una parte rilassata e una contratta che si alternano, mentre nel tira-nervo tutte le fibre sono contratte). Se questo s’innesca, il tira-nervo o crampo, il muscolo ha le fibre contratte:una delle cause è un calo di potassio, il quale dovrebbe rimanere sempre costante per la pompa sodio-potassio; se questa pompa s’inceppa, il potenziale d’azione si blocca (quindi il muscolo è tutto contratto). Per sbloccarlo bisogna tirare i muscoli, così si separano i legami fisici tra actina e miosina (i ponti) e si distende la fibra.
Sono gli anticorpi monoclonali. Sono estratti da un unico clone di linfociti B e sono anticorpi complementari ad un antigene che ci interessa in un dato momento. Quando trovo una molecola che caratterizza un tumore, la inoculo in un topo, che la riconosce come estranea, producendo anticorpi contro di essa. Dopo di che si estrae il sangue dal topo e si raccolgono i linfociti B che hanno gli anticorpi complementari agli antigeni. A questo punto si raccolgono gli anticorpi e si inoculano nel paziente malato.
Ci sono però due problemi principali: innanzitutto i linfociti B in cultura non sopravvivono, sono difficili da tenere in vita in vitro. Due scienziati, vincitori di un premio Nobel (Kohler e Milstein), però, hanno trovato il modo di mantenere in vita i linfociti B: hanno fuso, tramite un alcol (polietilenglicole), i linfociti B murini con le cellule del mieloma umano, ottenendo delle cellule ibridoma (per metà murine, per metà umane) cellule immortalizzate (cioè immortali, come le cellule dei tumori), capaci di produrre anticorpi, come linfociti, continuamente. [il mieloma è il tumore delle plasmacellule, rientra nella categoria dei linfomi, che sono tumori del sangue diversi dalle leucemie, che sono tumori liquidi, mentre i linfomi sono solidi e si vedono nei linfonodi].
Un altro problema è che questi anticorpi provengono da un topo (sono, appunto, murini), quindi non vanno bene, perché i pazienti danno rigetto immediato, con non pochi problemi. Per risolvere questo problema, entra in gioco l’ingegneria genetica, che sostituisce gran parte degli anticorpi murini con anticorpi umani.
Per superare il fatto che la parte variabile sia ancora murina, si sono creati topi geneticamente modificati, che hanno nel loro genoma i geni per gli anticorpi umani, così da produrre anticorpi interamente umani. Hanno usato un sistema di biotecnologie chiamato gene targeting, dove hanno sostituito la porzione di gene interessato con un gene umano.
.
Gli Interferoni
La famiglia degli interferoni è stata la prima famiglia di citochine ad essere scoperta.
Nel 1957 i ricercatori osservarono che se le cellule animali sensibili erano esposte a virus in grado di colonizzarle, queste cellule diventavano immediatamente resistenti all’attacco di altri virus.
Questa resistenza era indotta da una sostanza secreta dalle cellule infettate nominata
INTERFERONE. Successivamente è stato visto che molte specie producono un intero range di interferoni.
L’uomo produce almeno 3 distinte classi di IFN :
- IFNa
- IFNb
- IFNg.
Questi interferoni sono prodotti da una serie di diversi tipi cellulari.
Essi presentano un ampio range di effetti biologici, che includono:
l’induzione di resistenza cellulare all’attacco virale ;
la regolazione di vari aspetti della risposta immunitaria;
la regolazione della crescita e della differenziazione di molti tipi cellulari ;
il nutrimento nelle prime fasi della gravidanza in alcune specie animali.
Nessun singolo IFN mostrerà tutte queste attività biologiche.
Gli effetti sono dovuti al legame dell’IFN al suo specifico recettore membranale presente nella membrana plasmatica delle cellule sensibili.
IFN-a e IFN-b mostrano una significativa omologia della sequenza amminoacidica del 30% circa.Essi:
* si legano al medesimo recettore,
* inducono risposte biologiche simili e
* sono stabili agli acidi.
Per queste ragioni essi sono collettivamente attribuiti alla classe degli IFNs di tipo I o IFNs stabili agli acidi.
L’IFN-g è distinto dal punto di vista evoluzionistico dagli altri IFN:
* esso si lega ad un recettore separato, diverso ed
* induce una diversa rosa di attività biologiche.
Esso, pertanto, viene spesso chiamato IFN di tipo II.
Per il tipo di attività biologiche che presentano molti IFNs sono d’uso corrente o futuro per il trattamento di molte condizioni patologiche che includono:
l’aumento della risposta immunitaria contro agenti infettivi (virali, batterici, protozoari, ecc.) ;
il trattamento di alcune malattie autoimmuni;
il trattamento di certi tipi di cancro.
Gli IFNs possono essere determinati e quantificati utilizzando vari tests biologici o attraverso tests
immunoenzimatici.
Inizialmente si è dimostrato difficile il loro utilizzo a causa delle piccole quantità nelle quali tali proteine erano prodotte naturalmente dall’organismo.
Gli sviluppi nei recenti anni ‘70 della tecnologia delle colture cellulari animali, insieme con la identificazione di cellule che producono aumentate concentrazioni di IFNs, ne hanno reso disponibili alcuni in quantità ragionevoli (soprattutto gli IFN-a).
E’ stato solo con l’avvento dell’ingegneria genetica che è stato possibile produrre tutti gli IFN in quantità sufficiente per soddisfare la domanda per fini puri ed applicati.
-La biochimica dell’interferone a-
Si è notato che esso rappresenta un singolo prodotto genico.
E’ ora noto che tutte le specie producono IFN-a strettamente correlati fra loro.
Negli anni ‘70 sono stati gli studi di purificazione utilizzando tecniche cromatografiche, tipo HPLC (principalmente a scambio ionico, gelfiltrazione, cromatografia di immunoaffintà e isoelectric focusing), che per primi hanno reso la cosa nota .
Nell’uomo esistono almeno 24 geni che codificano per la produzione di almeno 16 distinti tipi di IFN-a maturi.
Tutti presentano all’inizio un peptide segnale aggiuntivo di 23 amminoacidi.
La massa molecolare di tutti gli IFN-a è dell’ordine di 19-20 KDa.
E’ stata osservata eterogeneità nei valori dei pesi molecolari ottenuti con tecniche diverse, molto probabilmente ciò si deve alla O-glicosilazione, anche se molti IFN non sono glicosilati.
Alcuni , poi, mostrano una certa eterogeneità naturale a causa del limitato processo proteolitico al C-terminale.
Ogni IFN-a mostra in generale una omologia amminoacidica in eccesso del 70% con gli altri (della stessa famiglia).
Questi interferoni sono ricchi di Leucina e Acido Glutammico e presentano Cisteine conservate (solitamente nelle posizioni :1, 29, 99 e 139). Queste generalmente formano legami disolfuro che stabilizzano la molecola matura.
La loro struttura terziaria è simile:
Interferone a-2B (theoretical model)
* contenengono molti segmenti ad a-elica,
* ma sembrano mancare di foglietti b.
I singoli membri di tale famiglia di IFN hanno un nome che li identifica. In molti casi i nomi sono assegnati piazzando una lettera dopo la “a” ; esistono comunque anche eccezioni che vedono IFN-a seguito da un numero o da un numero ed una lettera. Molti sono noti con due nomi diversi.
-La biochimica dell’interferone b
Esso è normalmente prodotto dai fibroblasti ed è da queste cellule che è stato purificato per la prima volta.
L’uomo sintetizza:
una singola molecola di IFN-b,
che contiene 166 residui amminoacidici
che presentano un 30% di sequenze omologhe con IFNa.
La molecola matura presenta un singolo legame disolfuro .
Essa è una glicoproteina di massa molecolare maggiore di 20 KDa.
La catena laterale zuccherina è attaccata attraverso un legame glicosidico all’azoto di un residuo di Asparagina (residuo 80).
Lo zucchero facilita una purificazione parziale attraverso la cromatografia di affinità con
lecitina. La cromatografia di immunoaffinità che usa gli anticorpi monoclonali diretti contro
IFN-b, così come altri tipi di cromatografia, è stata anch’essa impiegata nella sua purificazione.
La struttura terziaria di IFN-b è dominata da 5 a-eliche, delle quali:
Interferone-b; catene : A e B; ingegnerizzato. La sua struttura è stata ottenuta con il
metodo della diffrazione dei raggi X.
3 viaggiano parallele
mentre le altre due sono antiparallele.
- La biochimica dell’interferone g -
Questo IFN è prodotto soprattutto dai linfociti .
La sua sintesi è indotta in queste cellule quando esse vengono in contatto con un antigene esposto.
Citochine, come IL-2 e IL-12, possono anch’esse indurre la produzione di questo interferone in determinate situazioni.
Esiste un singolo gene IFN-g, localizzato sul cromosoma 12 umano, che codifica per questo IFN.
Esso mostra una piccola omologia con i geni degli IFN di tipo I.
Il polipeptide maturo:
contiene 143 amminoacidi ed
ha una massa molecolare prevista di 17 KDa.
A seconda del grado di glicosilazione si possono ottenere dati diversi relativi alla massa molecolare dell’IFN: sono state rivelati 3 valori di massa molecolare 16-17, 20 e 25 KDa.
Il valore 20 KDa sta ad indicare la glicosilazione dell’Asparagina 97, mentre il valore 25 KDa indica la glicosilazione dell’Asparagina 25 e dell’Asparagina 97.
Inoltre, l’IFN-g maturo presenta una grande eterogeneità al suo terminale carbossilico a causa del processo proteolitico (sono state identificate 5 forme tronche).
La sua struttura terziaria consiste:
Interferone-Gamma : la sua struttura è stata ottenuta con l’ausilio della
diffrazione dei raggi X.
di sei segmenti ad a-elica
legate da regioni che non sono ad a-elica.
L’IFN-g può anche essere sottoforma di dimero o di trimero, anche se la sua forma biologicamente attiva sembra essere un omodimero nel quale le due subunità sono associate in modo antiparallelo.
- La trasduzione del segnale dell’interferone -
Tutti gli IFN mediano il loro effetto biologico attraverso il legame ad alta affinità con i recettori sulla superficie cellulare.
Il legame è seguito dalla trasduzione del segnale, che culmina in un alterato livello di espressione di molti geni .
Esiste sia una regolazione positiva che una regolazione negativa, finora, però, è stata studiata nel dettaglio solo la regolazione positiva di espressione dei geni .
Tutti i geni stimolati dall’IFN sono caratterizzati dalla presenza a monte di un Elemento di
Risposta Stimolato dall’Interferone (ISRE).
La trasduzione del segnale culmina nel legame di specifici fattori di regolazione all’ISRE, che stimola la trascrizione dei geni sensibili all’IFN mediata dalle RNA-Polimerasi II.
I prodotti gene-indotti, poi, mediano gli effetti: antivirale, immunomodulatorio ed anche tutti gli altri indotti dagli IFN.
- I recettori degli interferoni -
La disponibilità di grandi quantità di IFN purificati facilita lo studio dettagliato dei recettori.
Possono essere intrappresi studi di legame che utilizzano IFN radiomarcati mentre la fotoaffinità di legame dell’IFN marcato con il suo recettore facilita la successiva purificazione del complesso IFNrecettore.
La tecnologia del DNA ricombinante ha anche facilitato il clonaggio diretto dei recettori dell’IFN. Studi di binding che utilizzano gli IFN radiomarcati di tipo I rivelano che essi competono tutti per il legame sullo stesso recettore, invece l’IFN di tipo II purificato non compete.
E’ stato clonato il recettore per l’IFN-a ed il gene è situato sul cromosoma 21 umano.
Gli studi hanno rivelato che esistono due tipi di recettori polipeptidici per gli interferoni di tipo I.
Entrambi:
appartengono alla famiglia di recettori polipeptidici per le citochine di classe II e
sono glicoproteine transmembrana N-glicosilate.
I dati della sequenza sono stati ottenuti con studi di clonaggio.
Grazie alle loro forme isolate si è scoperto che:
un polipeptide (chiamato a/b recettore) è capace di legare tutti gli interferoni di tipo I.
L’altro (ab recettore) è specifico per l’IFN-ab, uno specifico membro della famiglia degli
IFN-a.
Entrambi i recettori sono presenti in molti tipi cellulari.
Il recettore dell’IFN-g (recettore di tipo II) mostra una distribuzione più limitata dei recettori di tipo I.
Questo recettore è:
una glicoproteina transmembrana
di massa molecolare 50 KDa,
che sembra funzionare come un omodimero.
La regione di legame extracellulare dell’interferone consiste di circa 200 residui amminoacidici strutturati in due domini omologhi.
L’inizio della trasduzione del segnale richiede anche la presenza di una seconda glicoproteina transmembrana nota come AF-1 (fattore accessorio - 1) che si associa con la regione extracellulare del recettore.
La serie di eventi intracellulari che hanno luogo con il legame degli IFN di tipo I o II ai loro
rispettivi recettori è nota come JAK-STAT PATHWAY.
Questa via gioca un ruolo fondamentale nel mediare la trasduzione del segnale, non solo per IFN ma anche per molte altre citochine.
- The JAK-STAT pathway -
I recettori per le citochine possono essere suddivisi in due gruppi:
quello il cui dominio intracellulare presenta attività intrinseca Tirosin-Chinasica e
quello il cui dominio intracellulare risulta privo di tale attività. Molti recettori appartenenti a quest’ultimo gruppo, comunque, attivano Protein-Chinasi intracellulari solubili attraverso il legame del ligando.
Le Giano-Chinasi (JAKs) rappresentano una famiglia di protein chinasi recentemente scoperta che sembra giocare un ruolo centrale nel mediare la trasduzione del segnale di molte citochine.
Questi enzimi ospitano due potenziali siti attivi ed è stato dato loro il nome di Giano dal nome del dio romano con due faccie. E’ probabile che solo uno di questi siti “attivi” sia funzionale.
Sono quattro i membri della famiglia degli JAK che sono stati caratterizzati:
JAK-1
JAK-2
JAK-3 e Tyk-2.
Essi presentano:
massa molecolare di circa 130 KDa ed un 40% circa di sequenze amminoacidiche omologhe.
Essi sembrano associati con il dominio citoplasmatico di molti recettori per le citochine, ma
rimangono cataliticamente inattivi fino al legame della citochina al recettore
In molti casi il legame del ligando sembra promuovere la dimerizzazione del recettore portando in stretta vicinanza i loro JAK associati.
Gli JAK, poi, si fosforilano e si attivano l’un l’altro (TRANSFOSFORILAZIONE).
Le chinasi attivate successivamente fosforilano specifici residui di Tirosina sullo stesso recettore.
Questo promuove la associazione diretta fra uno o più membri di una famiglia di proteine
citoplasmatiche - gli STATs - ed il loro recettore.
Una volta legati alla superficie del recettore, gli STAT vengono a turno fosforilati (quindi attivati) dagli JAK.
Gli STAT, poi, traslocano nel nucleo e regolano direttamente l’espressione dell’IFN e di altri geni sensibili alle citochine.
“STAT” sta per “ Trasduttori del segnale e attivatori della trascrizione”. Come suggerisce il nome, queste proteine sono parte integrante della trasduzione del segnale iniziata da certe molecole
e sono responsabili dell’attivazione della trascrizione di specifici geni nel nucleo.
Finora sono stati identificati ben sei distinti tipi di STAT mammiferi (da STAT 1 a STAT 6).
Diverso è il numero di proteine funzionali in ogni famiglia.
Gli STAT sono presenti anche in specie non mammifere, come nella “mosca della frutta”.
Tutti gli STAT presentano omologia significativa nella sequenza di amminoacidi e sono composte da un certo numero di domini funzionali .
Il dominio SH2 funziona per legare la fosfotirosina, quindi per staccare lo STAT dalla superficie del recettore attivato. Questo dominio è anche richiesto per l’interazione degli STAT con gli JAK (che poi fosforilano gli STAT) e per promuovere la successiva dimerizzazione degli STAT.
Una tirosina essenziale è localizzata vicino al carbossi-terminale dello STAT, che viene fosforilata a turno dalla protein-tirosin-chinasi.
Gli STAT sono distribuiti in modo differente nelle varie cellule di diversi tessuti.
STAT 1, 2 e 3 sembrano essere presenti in molti tipi cellulari , mentre la distribuzione tissutale di STAT 4 e5 è più limitata.
Ligandi diversi attivano membri diversi della famiglia degli STAT .
La fosforilazione dello STAT assicura il suo legame al recettore, con il conseguente distacco dal recettore in forma di dimero.
Si crede che la dimerizzazione di uno STAT richieda l’associazione fra il dominio di uno SH2 di uno STAT e la fosfotirosina del suo partner.
La dimerizzazione sembra essere un prerequisito essenziale per il legame con il DNA.
I dimeri possono essere composti:
da due STAT identici,
o da eterodimeri, che spesso si formano in risposta a certe citochine.
I dimeri di STAT, poi, traslocano attraverso un meccanismo non chiarito al nucleo dove si legano a specifiche sequenze di DNA.
Gli STAT legano specifiche sequenze del DNA che sono quasi simmetriche simmetria o
palindromiche (spesso TT CC X GG AA , dove X può essre dato da basi diverse).
Queste sequenze di basi sono normalmente presenti nelle regioni di regolazione a monte di geni specifici.
Il legame del complesso dello STAT aumenta la trascrizione di questi geni e i prodotti genici posta cellulare osservata per legame delle citochine
mediano la r .
Fonte: http://liceocuneo.it/cussino/wp-content/uploads/sites/11/SISTEMA-IMMUNITARIO-modificato2.doc
Sito web da visitare: http://liceocuneo.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve