Los resúmenes, toma nota de los textos que figuran en nuestra página web se ponen a disposición de forma gratuita con fines didácticos de la ilustración, científica, social, civil y cultural a todos los posibles interesados de acuerdo con el concepto de uso justo, y con el 'objetivo de cumplimiento de la Directiva Europea 2001/29 / CE y del «arte. 70 de la ley 633/1941 sobre derechos de autor
La información médica y de la salud en este sitio es de carácter general y para propósitos informativos solamente y por lo tanto no puede en ningún caso sustituir el consejo de un médico (o un autorizado legalmente a la profesión).
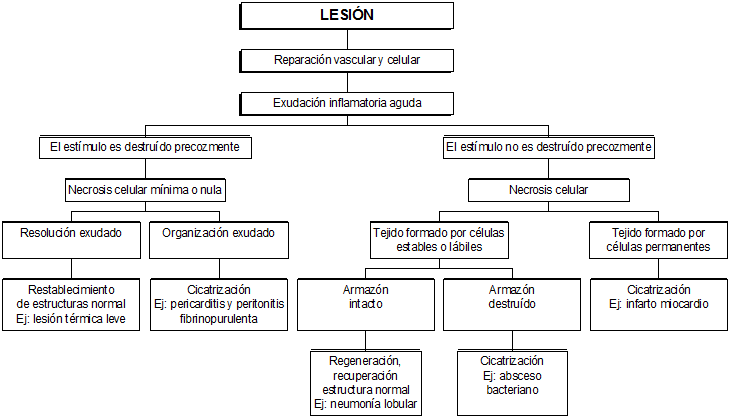
REPARACIÓN
Es el reemplazo de los tejidos dañados o perdidos, desde el punto de vista morfológico y funcional. No siempre esto se logra completamente, a veces solo se logra la reparación de lo morfológico.
La reparación comienza en el mismo momento que empieza la inflamación. Son procesos paralelos.
Existen 2 reparaciones:
Esto trae ventajas y desventajas. La principal ventaja es que si algunas células, como las neuronas, se regenerara, se perdería mucha información.
Hay otros mecanismos de reparación: trasplantes, prótesis, restitución tisular.
El que un tejido pueda regenerarse o ir a la cicatrización depende del tipo de célula. Existen 3 grupos:
Para que se regeneren estas células se requiere un estroma en buenas condiciones y una membrana basal.
Hay 3 factores en la reparación tisular:
Todo esto está muy comunicado y relacionado, entre las células y la matriz y las células entre sí y los factores de crecimiento, que a través de receptores de membrana llamados integrinas mediante mensajeros solubles envían mensajes al núcleo, lo que lleva a la célula a una respuesta: diferenciación, migración, proliferación, etc.
Neutrófilos y macrófagos
Fagocitan, sin ellos no habría proceso reparativo, sobre todo sin los macrófagos, ya que producen factores de crecimiento derivados de macrófagos (FCDM) que estimulan la proliferación a muchas células, sobre todo al fibroblasto
La plaqueta se activa cuando sale del vaso y entra en contacto con el colágeno subendotelial, fibrina y trombina, entonces:
Fibronectina
Existe una plasmática y una tisular.
La plasmática tiene las siguientes capacidades:
Modelo de reparación: curación de una herida.
Aquí hay regeneración y cicatrización. Las etapas se dan en forma paralela.
Tejido de granulación
En la primera armazón juegan su rol la fibronectina, fibroblastos (fibroplasia), células mesenquimáticas indiferenciadas (que se diferencia a miofibroblastos y fibroblastos), células endoteliales, macrófagos. Al 2º-5º día los fibroblastos sintetizan una matriz extracelular, fibronectina tisular, proteoglicanos y colágeno tipo III. El colágeno tipo III se produce a partir de las 24 hrs; el tipo I al 7º día (este es capaz de unirse, gracias a la fibronectina, a fibroblastos y vasos). Paralelo a esto sigue la fagocitosis y angiogénesis.
Para tener tejido de granulación debe haber fibroplasia y angiogénesis.
Angiogénesis
Proceso por el cual se forman los nuevos vasos para devolver la vascularización de la zona dañada. Esto se logra por un proceso de yemación de vasos sanos preexistentes en la periferia del tejido dañado.
Son necesarios estímulos angiogénicos:
Comienza entre el 2º y 5º día, consta de las siguientes etapas:
En un primer tiempo el tejido de granulación tiene muchos capilares con zonas ocludens muy grandes, lo que genera mucho edema; posteriormente el tejido es más fibroso y con menos capilares.
Tejido de granulación
Fibronectina + fibrina + eritrocitos + plaquetas: Primera malla
Quimiotáctico para:
Células mesenquimáticas indiferenciadas Células endoteliales (angiogénesis)
Fibroblastos
Activado (4º-5º día)
Matriz extracelular
Fibronectina tisular
Proteoglicano + Neovasculatura = Tejido de granulación
Colágeno III (24 hrs)
Colágeno I (7º día)
(No olvidar la acción de macrófagos y miofibroblastos)
El tejido de granulación es muy blando, muy celular, y constituye un fácil caldo de cultivo para microorganismos.
Modelo de regeneración epitelio
Primeramente se cubre de exudado fibrinoso o hemorrágico, lo que hace de barrera física y frente a agentes infecciosos. Al 8º día se observa un aumento de la capilaridad; a las 2 semanas aumenta el colágeno.
El coágulo se transforma luego en tejido de granulación, y luego en tejido fibroso.
Remodelación: consiste en una devascularización, aumentan los enlaces cruzados entre las fibras de colágeno, aumenta también la tensión de las fibras colágenas porque están más maduras; las colagenasas destruyen al colágeno III, posteriormente hay inhibición de las colagenasas; hay también remodelación producto de los movimientos musculares. A los 2-3 meses se adquiere la resistencia y forma definitiva.
De acuerdo a cómo queden los extremos de una herida se dan 2 casos:
Como condición, el cuerpo neuronal debe estar intacto. Existen 3 tipos de daño, el primero es el más leve.
REPARACIÓN ÓSEA
En general, en huesos largos. La reparación depende de:
Tipos de fractura
De acuerdo al compromiso de otras estructuras:
De acuerdo al rango de fracturas:
De acuerdo al número de fracturas:
A medida que la fractura se va complicando, la reparación se hace más lenta.
En una fractura se produce un coágulo que será inducido, por las células que lo rodean, a formarse en hueso. Se describen etapas que van en forma casi simultánea:
Al producirse la fractura hay ruptura de vasos al interior del hueso, ruptura de periostio y de tejidos blandos adyacentes. Todo esto determina un coágulo muy grande que va más allá de los bordes de la fractura.
El tejido óseo adyacente a la fractura sufre necrosis por interrupción del aporte sanguíneo.
La formación del coágulo es similar al normal. El coágulo es rico en fibrina, fibronectina, luego es invadido por células inflamatorias; los macrófagos comienzan a fagocitar restos de tejido necrótico; las células mesenquimáticas indiferenciadas se transforman en fibroblastos que sintetizan colágeno tipo I y III; también hay proliferación de células endoteliales. Por tanto, el callo se presenta ya a los 2 o 3 días.
Se produce la diferenciación a tejido óseo, pues el coágulo organizado comienza lentamente a presentar zonas de cartílago y tejido osteoide. Hay muchos fibroblastos y condrocitos que se encargarán de madurar al coágulo.
La parte externa del precallo está bajo la inducción del periostio que aportará la irrigación y las células tipo osteoblastos que lentamente comienzan a invadir el callo. La parte interna del precallo está bajo la inducción del endoostio y de células indiferenciadas de la médula ósea.
A nivel cortical, la transformación del callo se produce en base a los conos de corte, que son tunelizaciones corticales realizadas por osteoclastos, seguidos por osteoblastos y un vaso sanguíneo.
Al finalizar la primera semana se comienza a mineralizar el tejido óseo y se comienza la formación de tejido óseo maduro.
Al finalizar el mes el callo óseo es muy voluminoso, siendo remodelado por la acción de músculos y tendones, fuerzas y tensiones que inciden sobre este callo y lo van remodelando hasta que adquiere las mismas características del tejido óseo antes de la fractura. El proceso de remodelación puede durar varios meses o años.
Esto equivale a una cicatrización por segunda intención. Es posible que los fragmentos sean llevados a una posición de íntima relación por medio quirúrgicos, en los cuales se emplean medios de osteosíntesis (alambres, placas y tornillos de acero o titanio o bien sean reabsorvibles). Aquí el coágulo que se forma es tan mínimo que la formación de tejido óseo comienza inmediatamente después de producida la fractura, siendo éste un tipo de reparación ósea por primera intención.
En los huesos faciales, principalmente la mandíbula, la transformación del coágulo en tejido ósea es por osificación primaria, es decir, no pasa por la formación del callo fibrocartilaginoso (no hay cartílago).
La reparación de algunas fracturas puede verse alterada por algunas enfermedades, por ejemplo: osteoporosis, enfermedad de Paget, déficit nutricional, infecciones, etc.
Una de la primeras maniobras para que se presente la reparación ósea es la inmovilización de los rasgos de la fractura. Si no es así, el estímulo que produce el movimiento constante sobre el callo inducirá a la formación de tejido fibroso o cartilaginoso, produciéndose una seudoartrosis, pues las células mesenquimáticas se convertirán en células sinoviales y cartílaginosas. Cuando esto pasa el paciente debe ser intervenido para iniciar un nuevo proceso de reparación ósea.
La fractura puede ser:
Normalmente las fracturas completas son con desplazamiento.
(Distracción osteogénica: se aprovecha el callo, se estira, logrando un crecimiento de 1 cm)
Es homóloga a una cicatrización por segunda intención de los tejidos blandos. Luego de una extracción, el espacio se llena de un coágulo de sangre, que luego es llenado con tejido óseo.
La hemorragia intraalveolar permite la formación de un coágulo rico en glóbulos rojos y fibrina. El tejido gingival que se encuentra adherido al cuello del diente queda sin soporte y cae dentro del alvéolo, ayudando a mantener el coágulo en posición. Además el anillo rígido que forma la cresta alveolar ayuda a mantener este coágulo. La mantención del coágulo dentro del alvéolo es imprescindible para que se lleve a efecto la reparación; en los casos en que se pierde la reparación es muy lenta, pudiendo incluso ser dolorosa.
Durante las primeras 24-48 horas post extracción se observa en la periferia del coágulo un edema por vasodilatación o ingurgitación de los vasos sanguíneos remanentes en el ligamento periodontal. También hay infiltración de LPN. El coágulo se encuentra cubierto en su superficie por una delgada capa de color blanquecino que corresponde a fibrina, la que puede ser confundida por algunos pacientes por exudado purulento, lo que lo lleva a removerla.
Durante la primera semana se produce una proliferación de fibroblastos a partir de células provenientes del ligamento periodontal y de los espacios medulares circundantes. Este coágulo es lentamente reemplazado por tejido de granulación, ya que sufre un proceso de organización por proliferación de células endoteliales y mayor actividad fibroblástica.
El epitelio de la periferia de la herida comienza a proliferar tal como se ha visto.
Durante la inflamación aguda se produce eliminación de desechos como células muertas, tejido necrótico, huesos, removidos por neutrófilos, macrófagos y osteoclastos, también a nivel de la cresta alveolar se aprecia el comienzo de la osteoclasia. Durante la segunda semana se completa la organización, los remanentes del ligamento son muy escasos y en la pared alveolar también se aprecia actividad osteoclástica, pudiendo incluso haber trabéculas de osteoide que se extienden fuera de la pared alveolar. El epitelio de la superficie puede haber cubierto el defecto, especialmente en los alvéolos pequeños, como en los incisivos anteroinferiores, mientras que en los molares todavía está incompleto. A nivel de la cresta alveolar se aprecia mayor actividad osteoclástica.
En la tercera semana el coágulo está completamente organizado con tejido de granulación maduro y en la periferia del alvéolo hay formación de osteoide y hueso inmaduro que con el tiempo va aumentando desde la base hacia la superficie del alvéolo y desde la periferia hacia el centro. Este tejido neoformado se forma por osteoblastos derivados de células indiferenciadas del ligamento periodontal. El hueso cortical sufre una remodelación, de tal modo que ya no es una capa tan densa y la cresta alveolar ya se ha redondeado. La superficie de la herida se encuentra completamente epitelizada.
Cuarta semana y siguientes, etapa final de la reparación, que puede durar hasta los 6 meses o más, donde el tejido neoformado madura hasta transformarse completamente en hueso.
Es importante tener presente que la remoción o pérdida de la tabla externa o interna dará como resultado la formación de un reborde alveolar más pequeño; este tejido óseo es básico para hacer rehabilitación protésica.
COMPLICACIONES
Es la complicación más frecuente de las extracciones. Consiste en una osteomielitis focal donde se pierde el coágulo, hay producción de olor fétido y dolor. Se describen 2 tipos:
Complicación poco común que por lo general se debe a una extracción difícil y se produce con mayor frecuencia cuando se pierden las corticales labiales y bucales junto con el periostio. En la radiografía se aprecia una zona radiolúcida circunscrita.
FACTORES QUE MODIFICAN LA CICATRIZACIÓN
Existen factores de la injuria y factores dependientes del huésped, en estos últimos se distinguen factores generales y locales.
Factores generales
Los corticoides se usan como antiinflamatorios. A veces se produce demasioda cicatriz, lo que se conoce como queloides, los que pueden ser tratados con corticoides.
Factores locales
La radiación UV favorece la reparación.
Además favorece la reparación el uso de oxígeno en alta concentración, como en las cámaras hiperbáricas que se usan en los enfermos con osteomielitis.
COMPLICACIONES DE LA CICATRIZACIÓN
Contracción excesiva de la cicatrización debido a los miofibroblastos; se produce en quemaduras cutáneas, estenosis esofáfica, etc.
Una herida termina de cicatrizar al año.
Fuente del documento: http://www.idap.com.mx/apuntes/Patologia/Reparacin(4).doc
Sitio para visitar: http://www.idap.com.mx/
Autor del texto: Esteban Arriagada
Las letras son propiedad de sus respectivos autores y les damos las gracias por la oportunidad que nos brindan para conocer sus textos libres para fines ilustrativos y educativos. Si usted es el autor del texto y que está interesado para solicitar la eliminación del texto o la inserción de otra información envíe un correo electrónico después de que los controles adecuados que va a satisfacer su solicitud tan pronto como sea posible.
Los resúmenes, toma nota de los textos que figuran en nuestra página web se ponen a disposición de forma gratuita con fines didácticos de la ilustración, científica, social, civil y cultural a todos los posibles interesados de acuerdo con el concepto de uso justo, y con el 'objetivo de cumplimiento de la Directiva Europea 2001/29 / CE y del «arte. 70 de la ley 633/1941 sobre derechos de autor
La información médica y de la salud en este sitio es de carácter general y para propósitos informativos solamente y por lo tanto no puede en ningún caso sustituir el consejo de un médico (o un autorizado legalmente a la profesión).