I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
STUDIAMO LA MATERIA – Laboratorio di chimica e fisica
Le grandezze fisiche sono misurabili

La misura diretta consiste nel confrontare la grandezza da misurare con l'unità di misura. La misura indiretta, invece, si basa sulla misura di altre grandezze legate a quella da determinare.
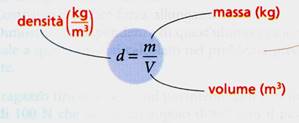
La densità di una sostanza è una grandezza derivata. La densità di un corpo omogeneo si determina mediante il rapporto fra la sua massa e il volume che occupa.
La misura e l'errore
Ogni volta che si misura una grandezza fisica si commettono degli errori, sistematici e/o accidentali. Se è possibile, si preferisce ripetere la stessa misura diverse volte. In questo caso, il valore più attendibile è la media aritmetica delle misure.
L'errore che si commette nel misurare una grandezza è detto errore assoluto.
L'errore percentuale èpiù significativo di quello assoluto, perché ci dà informazioni sulla precisione con cui è stata effettuata una misura.
• L'errore assoluto (ea) èuguale alla differenza tra il valore massimo e il valore minimo misurati diviso due (ea=valmax–valmin/2).
• La media x viene calcolata sommando tutti i dati ottenuti dalla misurazione e dividendo per il numero degli addendi.
• Il valore della misurazionesarà dato dalla media più o meno l'errore assoluto: x ± ea.
• L'errore relativo (er)siottiene dal rapporto tra l'errore assoluto e la media: (er=ea/x).
• L’errore percentualeè uguale all’errore relativo moltiplicato per 100 ed espresso in % : (ep=er·100)
• Le cifre significativeindicano l'incertezza della misurazione. Sono cifre significative tutti i numeri, tranne gli zeri che precedono, a sinistra, la prima cifra diversa da 0.
• L'arrotondamento deve tener conto delle cifre significative.

Il risultato di una misura può essere scritto in diversi modi fra loro equivalenti: associando al valore misurato l'errore assoluto o l'errore percentuale oppure indicando gli estremi di variazione.
La notazione scientifica o esponenziale
• I numeri molto grandi o molto piccoli si possono esprimere come potenze di 10.
• Si possono eseguire i calcoli con numeri espressi come potenze di 10; in questo caso valgono le regole delle proprietà delle potenze.
CALCOLI CON LE MISURE SIGNIFICATIVE
• Nelle moltiplicazioni e divisioni il risultato deve avere un numero di cifre significative pari a quello del numero che ne ha di meno (non vanno presi in considerazione numeri che non provengono da misure).
• Nelle addizioni e sottrazioni si deve mantenere nel risultato il numero di cifre decimali del numero che ne ha di meno.
ARROTONDAMENTO
• La prima cifra significativa incerta deve essere arrotondata:
per difetto, se <5
per eccesso, se ≥5
 Grandezze direttamente e inversamente proporzionali
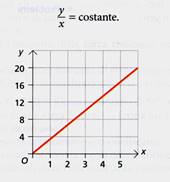
Grandezze direttamente e inversamente proporzionali
Le grandezze rappresentate nella figura a destra sono direttamente proporzionali: tuttii punti del grafico stanno su una semiretta e sono allineati con l'origine degli assi. Il rapporto fra le due grandezze si mantiene costante ed è rappresentato dalla pendenza della retta:
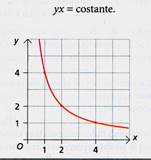
Nella figura a sinistra le due grandezze sono inversamente proporzionali: tutti i punti si trovano su un'iperbole. Il prodotto fra le due grandezze si mantiene costante.
LA PRESSIONE
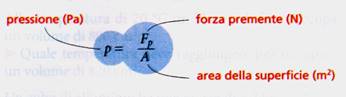
La pressione èil rapporto tra la forza premente su una superficie e l'area della superficie stessa. Nel S.I., la pressione si misura in pascal: 1 Pa = 1 N/m2. A parità di forza, la pressione è tanto maggiore quanto più piccola è la superficie su cui si esercita.
L'aria che ci circonda è pesante
La pressione atmosfericaèdovuta al peso dell'aria che circonda la Terra. È stata misurata per la prima volta da Torricelli.
A livello del mare e alle nostre latitudini, la pressione atmosferica equivale alla pressione che esercita una colonna di mercurio alta 76 cm (760 mm), cioè circa centomila pascal.
La pressione atmosferica diminuisce all'aumentare dell'altezza sul livello del mare.
Per la misura della pressione si utilizzano i barometri e i manometri.
Altre unità di misura in uso per la pressione atmosferica e loro conversioni.
Pressione atmosferica = 760 mmHg = 1 atm.
Si usa anche il bar = 105 Pa = 0,986 atm.
Quindi,
760 mmHg = 1 atm = 101325 Pa = 1,013 bar
1 mmHg = 133,322 Pa = 1,3∙10-3 atm
La temperatura e il calore
La temperatura dipende dallo stato di agitazione termica di un corpo; perciò è una grandezza fisica caratteristica del corpo stesso. Il calore, invece, spontaneamente si trasferisce da un corpo a temperatura più alta a uno a temperatura più bassa.
Nel Sistema Internazionale, la temperatura si misura in kelvin. Una variazione di temperatura (ΔT) espressa in gradi centigradi ha lo stesso valore se viene espressa in kelvin.
La dilatazione termica
Le sostanze cambiano dimensioni al variare della temperatura. In genere, le sostanze si dilatano, quando la temperatura aumenta, e si contraggono, quando la temperatura diminuisce, secondo la legge:
![]()
La costante kècaratteristica della sostanza chesi dilata o si contrae.
La legge fondamentale della termologia
La quantità di calore che un corpo acquista o cede quando la sua temperatura cambia di ΔT è:
![]()
cè il calore specifico del corpo.
La legge (legge fondamentale della termologia) non può essere applicata quando avviene un cambiamento di stato.
Quando due corpi che hanno diverse temperature T1 eT2 sono posti a contatto, dopo un po' di tempo raggiungono la stessa temperatura di equilibrio Te (principio dell'equilibrio termico) . In assenza di dispersione di calore, si ottiene l'equazione dell'equilibrio termico uguagliando il calore acquistato dal corpo freddo a duello ceduto dal corpo caldo:
![]()
I passaggi di stato
Quando il ghiaccio fonde la temperatura è 0 °C e rimane costante, finché il ghiaccio è tutto fuso; quando l'acqua bolle, la temperatura rimane fissa sui 100 °C. Ogni passaggio di stato avviene a temperatura costante.
Fusione edebollizione sono cambiamenti di stato che richiedono calore; i passaggi inversi, solidificazioneecondensazione, avvengono con cessione di calore da parte della sostanza che cambia stato.
La quantità di calore assorbita o ceduta durante il passaggio di stato è proporzionale alla massa della sostanza che cambia stato:
![]()
dove λ rappresenta il calore latente.
• I passaggi di statocomportano la trasformazione della materia da uno stato fisico all'altro (per esempio da liquido a solido) grazie a variazioni della temperatura e della pressione.
La propagazione del calore
Il calore si propaga spontaneamente da un corpo caldo a uno freddo e, all'interno dello stesso corpo, da punti a maggiore temperatura a punti a minore temperatura. Il calore si propaga nei solidi per conduzione, nei fluidi per convezione.
I GAS - L'equilibrio dei gas
Lo stato di equilibrio di una determinata quantità di gas è caratterizzato da tre grandezze fisiche: pressione, volume, temperatura, oltre che dalla quantità di gas. Variando una delle grandezze, il gas passa a uno stato diverso.
I GAS PERFETTI (o ideali)
E’ perfetto (o ideale) un gas che soddisfa le seguenti condizioni:
I gas perfetti obbediscono alle leggi illustrate di seguito.
LEGGE DI BOYLE (1662) - Isoterma (a temperatura costante)
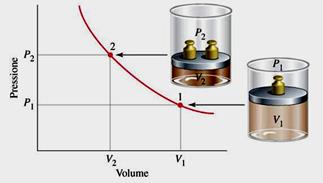
P∙V=k (Pressione e volume sono inversamente proporzionali).
A temperatura costante, se aumento il volume la pressione diminuirà in proporzione, in quanto diminuiscono gli urti sulle pareti del recipiente.
Posso anche esprimerla: P1∙V1 = P2∙V2
(iperbole equilatera)
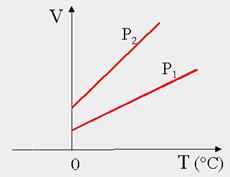
LEGGE DI CHARLES (1787) - Isobara (a pressione costante)
V = k ∙ T (Volume e temperatura sono direttamente proporzionali).
A pressione costante, se aumento la temperatura il volume aumenterà in proporzione.
Posso anche esprimerla: 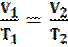
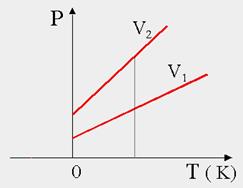
LEGGE DI GAY-LUSSAC (1802) - isocora (a volume costante)
P = k’ ∙ T (Pressione e Temperatura sono direttamente proporzionali).
Mantenendo il volume costante, se aumento la temperatura la pressione aumenterà in proporzione.
Posso anche esprimerla: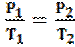
Le leggi di Charles e Gay-Lussac indicano che V e P di un gas diminuiscono con l’abbassarsi di T.
W. Thomson (Lord Kelvin), estrapolando le rette che descrivono le 2 leggi, osservò che entrambe incontrano l’asse delle ascisse nel punto t = -273,15 °C.

Questa temperatura limite alla quale un gas IDEALE non occupa né volume né esercita pressione, venne definita zero assoluto.
Kelvin propose una scala termometrica che parte dallo zero assoluto, di tipo centigrado, (scala Kelvin) il cui ZERO corrisponde alla temperatura di -273,15 °C.
EQUAZIONE DI STATO DEI GAS PERFETTI
Abbiamo visto che:
P 1/µ V (Boyle)
T µ V (Charles)
T µ P (Gay-Lussac)
Combinando le tre leggi si ricava che:
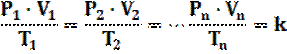
LA MATERIA - LE CARATTERISTICHE DELLA MATERIA
La CHIMICA è la scienza che studia la composizione, la struttura e le trasformazioni della materia. Tutto ciò che accade intorno a noi, dentro di noi, è materia e trasformazione di materia. La Chimica è in tutto questo.
Più precisamente, per materia si intende tutto ciò che occupa uno spazio, cioè è delimitato da un volume, ed è dotato di una massa.
Altre proprietà della materia sono per esempio: la densità(data dal rapporto massa/volume), la durezza, il colore, l'odore, la temperatura, la conducibilità elettrica, lo stato fisico(solido, liquido o aeriforme).
Gli stati fisici della materia
• La materia può esistere in 3 stati fisici diversi: liquido, solido e aeriforme. Gli stati della materia dipendono dalla costituzione della materia stessa, dalla temperatura e dalla pressione.
• Le proprietà caratteristiche dei tre stati della materia sono legate ai cambiamenti di volume, pressione, forma e densità.
|
SOLIDI |
LIQUIDI |
AERIFORMI |
Volume |
proprio |
proprio |
occupa tutto il volume disponibile |
Forma |
propria |
assume la forma del recipiente |
assume la forma del recipiente |
Densità |
alta |
media |
bassa |
Effetto della pressione |
incomprimibile (a pressioni non elevate) |
incomprimibile (a pressioni non elevate) |
comprimibile |
Variazione del volume in fuzione della T |
piccolissima |
piccola |
molto grande |
Variazione del volume in funzione della P |
piccolissima |
piccolissima |
molto grande |
Si definisce sistema un certo insieme, cioè una certa porzione, di materia di cui voglio esaminare il comportamento fisico, chimico o chimico-fisico. Il resto della materia circostante è definito ambiente.
Una porzione di materia, oltre a essere delimitata da superfici nette, può possedere in ogni punto le stesse caratteristiche (per esempio, di stato di aggregazione, calore, consistenza, ecc.): in tal caso viene più propriamente definita fase e costituisce un sistema omogeneo.
Una porzione di materia può anche essere formata da più fasi omogenee, per cui le sue caratteristiche non sono ovunque le stesse: in tal caso costituisce un sistema eterogeneo.
Sono trasformazioni fisiche quelle che un materiale subisce nella sua forma, senza che venga alterata la sua natura chimica. Ne sono esempi i cambiamenti di stato o la dissoluzione di un solido (come lo zucchero o il sale) in acqua. Dopo una trasformazione fisica si può ripristinare la situazione di partenza sempre con una trasformazione fisica (reversibilità delle trasformazioni fisiche). Per esempio, da un liquido trasformato in vapore si può per raffreddamento di quest'ultimo riottenere il liquido di partenza.
Le trasformazioni chimiche, o reazioni chimiche, sono quelle per cui un materiale è trasformato in un nuovo tipo di materiale, con proprietà chimiche diverse. La combustione del carbone o di un pezzo di legno, l'arrugginimento del ferro all'aria o la digestione degli alimenti sono esempi di trasformazione chimiche. Le trasformazioni chimiche sono generalmente irreversibili, vale a dire che nella maggior parte dei casi lo stato iniziale del sistema è irrecuperabile. Per esempio, dai prodotti della combustione del legno o del carbone non si può in nessun modo riottenere legno o carbone. Sono dette reversibili le reazioni chimiche, meno frequenti, in cui dai prodotti si possono ottenere di nuovo le sostanze di partenza.
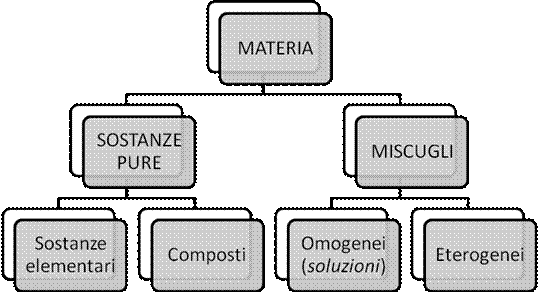
Sostanze (elementi e composti) e miscugli
Tutti i materiali sono costituiti da singole sostanze o da miscugli di due o più sostanze (questo è il caso di gran lunga più frequente).
Una sostanza è un materiale che possiede specifiche proprietà uguali in ogni punto (come già accennato) e che, inoltre, non può essere separato in un altro materiale per mezzo di processi fisici. Le sostanze si distinguono in:
I miscugli risultano dall'unione fisica di due o più sostanze e hanno una composizione e quindi proprietà chimiche e fisiche variabili da punto a punto. i miscugli si distinguono in:
Tipo di soluzione |
Esempio |
Componenti principali |
solido-solido |
acciaio |
Fe, C |
liquido-liquido |
grappa |
acqua, alcol |
liquido-solido |
acqua di mare |
acqua, Sali |
liquido-gas |
acqua gasata |
acqua, CO2 |
gas-gas |
aria |
N, O |
STRUTTURA DELLA MATERIA
Tutta la materia, compresa quella che costituisce gli organismi viventi più complessi, è costituita dalla combinazione di diversi elementi chimici. In natura sono presenti circa 92 elementi, molti dei quali ci sono familiari: l'ossigeno, per esempio, è presente nell'aria che respiriamo e nell'acqua, il calcio si trova nelle conchiglie di molti organismi, nei gusci delle uova, nelle ossa e nei denti degli animali, mentre il ferro è l'elemento responsabile del colore rosso del nostro sangue.
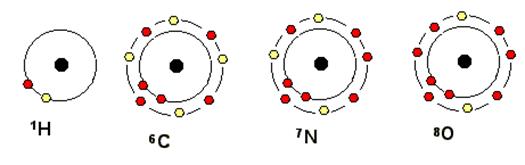
La più piccola particella di un elemento che possiede le proprietà di quell'elemento è un atomo. Ogni atomo ha un piccolissimo denso nòcciolo, il nucleo, che contiene una o più particelle cariche positivamente, i protoni, insieme a particelle di massa analoga ma elettricamente neutre chiamate neutroni.
Tutti gli atomi di un determinato elemento hanno lo stesso numero di protoni: questo numero caratterizza quell'elemento chimico ed è detto numero atomico (generalmente indicato con Z). Per esempio, gli atomi di idrogeno hanno un solo protone nel loro nucleo, mentre gli atomi di carbonio ne hanno 6 perciò, il numero atomico dell'idrogeno è 1 e quello del carbonio è 6. Se due atomi appartengono allo stesso elemento chimico, hanno perciò lo stesso numero di protoni, ma hanno un diverso numero di neutroni nel nucleo sono detti isotopi.
La somma dei protoni e dei neutroni corrisponde al numero di massa (generalmente indicato con A).
Due isotopi differiscono quindi per il numero di massa: per esempio, il numero di massa di un atomo di ossigeno che possiede 8 neutroni è 16, mentre l'isotopo dell'ossigeno che presenta 9 neutroni avrà numero di massa uguale a 17.
Il peso di un atomo di ciascun elemento (massa atomica o peso atomico) è la massa media di un atomo di quell'elemento, in rapporto alla massa di un atomo di carbonio-12, cioè di un atomo di carbonio con 6 protoni e 6 neutroni. Poiché in natura, in genere, un elemento è presente come miscela di isotopi, la massa atomica corrisponde alla media dei pesi atomici dei vari isotopi, considerando la relativa abbondanza percentuale.
Esternamente al nucleo si muovono, alla velocità della luce, leggerissime particelle cariche negativamente, gli elettroni, attratti dalla carica positiva dei protoni. In ogni atomo elettricamente neutro, il numero di elettroni è uguale al numero dei protoni presenti nel suo nucleo. Gli elettroni conferiscono all'atomo le sue proprietà chimiche, ossia influiscono sulla capacità e sul modo in cui un atomo può reagire con altri atomi. Come vedremo in seguito, le reazioni chimiche possono comportare spostamenti di elettroni da un atomo all'altro.
PROTONE e NEUTRONE ≈ massa UGUALE. Per praticità si usa la massa del PROTONE (o del NEUTRONE) come unità di misura della massa.
Massa elettrone ≈ 1/1840 massa protone.
Le interazioni tra atomo e atomo, che portano alle reazioni chimiche, sono stabilite dagli elettroni. Questi si trovano a determinate distanze dal nucleo e possono muoversi solo in certi determinati LIVELLI ENERGETICI, corrispondenti a ben definiti livelli quantizzati di energia; gli atomi, in base al loro numero atomico, possono avere 1, 2 o più livelli energetici.
Gli elettroni possiedono quantità variabile di energia a seconda della loro distanza dal nucleo: maggiore è la distanza, maggiore è la quantità di energia posseduta.
LE PROPRIETA’ CHIMICHE DI UN ELEMENTO DIPENDONO DAL NUMERO DI ELETTRONI PRESENTI NEL LIVELLO PIU’ ESTERNO.
Il 1° livello può contenere max n.2 elettroni;
Il 2° e oltre possono contenere max n. 8 elettroni.
 Elettroni mancanti per completare i livelli energetici
Elettroni mancanti per completare i livelli energetici
Elettroni presenti
Gli atomi che presentano i livelli più esterni incompleti sono molto reattivi, pertanto, attraverso le reazioni chimiche con altri atomi altrettanto incompleti, cercano di colmare il proprio livello più esterno incompleto (cioè cercano di raggiungere l’ottetto) [ cosa che non fanno i gas nobili che hanno già la loro orbita più esterna completa].
Gli atomi raggiungono questo obiettivo trasferendo o condividendo gli elettroni più esterni. Queste interazioni solitamente fanno sì che gli atomi vengano tenuti insieme da forze di attrazione chiamate legami chimici.
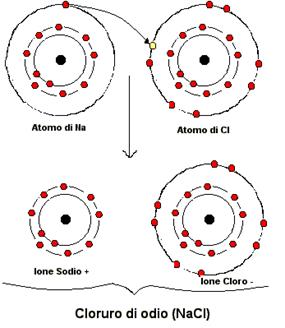
LEGAME IONICO
Ione = è un atomo (o molecola) provvisto di una carica elettrica
(- o +) che dipende dall’acquisizione o dalla perdita di 1 o più elettroni.
Due ioni aventi cariche opposte si attraggono; se l’attrazione è tale da legarli l’uno all’altro, il legame è detto LEGAME IONICO.
Cloruro di sodio (NaCl)
LEGAME COVALENTE
Si forma per la condivisione da parte di 2 atomi di una o più coppie di elettroni dei livelli più esterni.
Due o più atomi tenuti uniti da legami covalenti formano una molecola.
Fonte: http://www.liceofonseca.gov.it/public/file/LabChimica-Riassunto%20intero%20programma.doc
Sito web da visitare: http://www.liceofonseca.gov.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve