I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
I MINERALI SILICATICI
I silicati sono i minerali più abbondanti nella crosta terrestre e sono caratterizzati dalla presenza dello ione silicato (SiO4)4-, che rappresenta l'unità fondamentale del reticolo cristallino di questi composti.
Lo ione silicato ha una struttura tetraedrica, all’interno della quale ogni ione silicio Si4+ coordina 4 ioni O2-
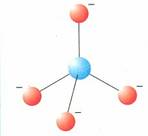
Lo ione silicio si trova al centro del tetraedro, mentre ai vertici sono collocati i 4 ioni ossigeno. Siccome lo ione silicato non è elettricamente neutro (possiede 4 cariche negative in eccesso, una per ogni atomo di ossigeno) il tetraedro può raggiungere la neutralità in tre modi:
La classificazione all'interno del gruppo dei silicati non è di tipo chimico ma strutturale, in quanto dipende dal modo in cui i tetraedri si uniscono tra loro.
CLASSIFICAZIONE DEI MINERALI SILICATI
NESOSILICATI (silicati isolati)
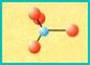
Nei nesosilicati i gruppi tetraedrici sono isolati. Le cariche negative dello ione silicato sono saturate da ioni metallici. Presentano generalmente durezza e peso specifico elevati. Esempio di nesosilicati sono le olivine, miscele di minerali con formula generale (Mg,Fe)SiO4. I cationi metallici che saturano le cariche negative sono di Magnesio o di Ferro.
Forsterite (Mg2SiO4)
OLIVINE
Fayalite (Fe2SiO4)
SOROSILICATI (coppie di tetraedri)
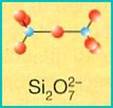
Sono costituiti da due tetraedri uniti per un vertice a formare un gruppo (Si2O7)6-. Le sei cariche negative sono bilanciate da cationi metallici. I rappresentanti più diffusi sono gli epidoti e la vesuviana, composti a formula complessa in cui troviamo vari cationi (Al, Ca, Mg ecc.), talora vicarianti tra loro (l’uno sostituisce l’altro).
CICLOSILICATI (tetraedri ad anello)
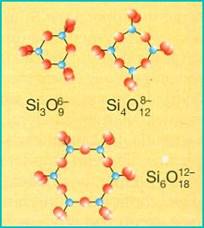
I ciclosilicati sono costituiti da anelli formati da 3, 4, 6 tetraedri, ognuno dei quali condivide 2 atomi di ossigeno con tetraedri dello stesso anello. Nella struttura gli anelli risultano sovrapposti l'uno sull'altro dando origine a cristalli di forma prismatica. Un esempio di ciclosilicato a 6 tetraedri è il berillo Be3Al2(Si6O18) una pietra preziosa che si presenta nelle varietà verde (smeraldo) e azzurra (acquamarina).
INOSILICATI: (tetraedri a catena)
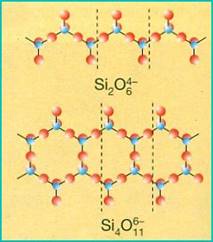
Negli inosilicati i tetraedri sono uniti tra loro a formare catene lineari indefinite; questa disposizione può essere di due tipi: semplice o doppia.
Prevalgono forme allungate e fibrose di cristalli, in quanto i legami sono molto saldi all'interno delle catene e piuttosto deboli tra catene adiacenti.
FILLOSILICATI (piani di tetraedri)
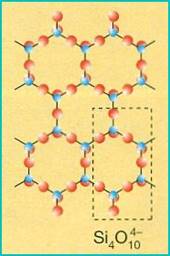
Nei fillosilicati un tetraedro condivide tre atomi di ossigeno con altrettanti tetraedri adiacenti a formare dei piani di esagoni; per questo motivo gli abiti dei cristalli sono lamellari e fogliacei con facile sfaldatura parallela ai piani. Il gruppo anionico che li caratterizza (Si4O10)4-, viene neutralizzato, tra un piano e l'altro, da quattro cariche positive fomite dai più comuni cationi metallici.
Le miche sono i minerali più rappresentativi del gruppo: tra esse ricordiamo la mica nera (biotite), contenente Ferro e Magnesio, e la mica bianca (muscovite), contenente Alluminio, nelle quali è molto accentuato il fenomeno della sfaldatura in sottili lamine parallele.
Sono silicati di questo tipo anche il talco ed i minerali argillosi (caolinite) che non si presentano mai in grossi cristalli, ma in masse porosa con struttura microcristallina o amorfa.
TECTOSILICATI (rete tridimensionale di tetraedri)
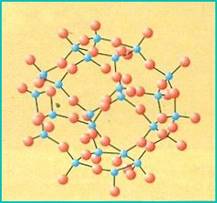
Nei tectosilicati i quattro atomi di ossigeno del tetraedro sono in comune fra tetraedri vicini, in modo che ogni atomo di ossigeno è legato a due atomi di silicio. La struttura che si forma è tridimensionale, continua e indefinita. In questo modo si genera un minerale molto diffuso nelle rocce della crosta terrestre continentale, il quarzo (SiO2).
L'alluminio può sostituire atomi di silicio all'interno dell'impalcatura tridimensionale, formando composti che sono definiti alluminosilicati:
la sostituzione di uno ione Si4+ con uno ione Al3+ permette l'inserimento nell'impalcatura cristallina di vari tipi di cationi monovalenti K+ o Na+ ; la sostituzione, invece, di due ioni Si4+ con due ioni Al3+, permette l’inserimento di cationi bivalenti come il Ca2+ .
Il gruppo di alluminosilicati che si ottiene costituisce i feldspati: feldspato potassico (ortoclasio), feldspato sodico (albite) ed il feldspato calcico (anortite).
L’albite e l’anortite sono isomorfi e per questo vengono riuniti nella serie (di feldspati) denominata plagioclasi (anortite = plagioclasio calcico, albite = plagioclasio sodico).
I feldspatoidi (simili ai feldspati) sono, invece, una classe di alluminosilicati che contiene, un minore numero di atomi di silicio rispetto ai feldspati.
Ritornando, infine, al quarzo (SiO2), si deve sottolineare che esso è l’unico tectosilicato che non presenta atomi di silicio sostituiti.
Ortoclasio (KAlSi3O8)
FELDSPATI Albite (NaAlSi3O8)
Plagioclasi
Anortite (CaAl2Si2O8)
Fonte: http://www.istitutovescovilenola.it/didattica/deangelis/appunti/geografia/I%20Minerali%20Silicatici.doc
Sito web da visitare: http://www.istitutovescovilenola.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve