I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Le proteine ed i processi alimentari: elementi essenziali
Le proteine sono polimeri di amminoacidi (19+1 + tutte le possibili modificazioni post traduzionali) il cui legame strutturale è detto “peptidico”.
Tutti gli AA hanno una base strutturale comune ed un gruppo chimico discriminante che li differenza detto gruppo R. In funzione della sequenza dei gruppi R la struttura di una proteina varia (cambiano gli angoli attorno ai piani definiti dai legami peptidici per via del peculiare folding proteico guidato dai dalle interazioni tra i vari gruppi R).
Si tratta di interazioni deboli in condizioni fisiologiche. Queste interazioni vengono però modificate durante i processi di trasformazione chimici e fisici dei prodotti alimentari: Tali modifiche strutturali si ripercuotono naturalmente a livello funzionale ed è per questo che sono così importanti per il comportamento della componente proteica durante i processi industriali e domestici cui vengono sottoposti gli alimenti.
L’unica interazione covalente è il ponte disolfuro S-S. E’ importante in quanto lo Zolfo è un atomo molto reattivo. Possiamo trovarlo come SH solo in ambienti riducenti in quanto si ossida con facilità dando luogo a S-S. Nei processi alimentari la formazione dei ponti disolfuro può essere desiderata come nel caso del glutine, ma anche dannosa come nel caso dei trattamenti termici del latte dove la formazione di un ponte S-S tra la b-lattoglobulina e la k-caseina determina una riduzione delle proteine solubili.
Tra le interazioni deboli ricordiamo le forze di Van Der Waals (interazione idrofobica), i dipoli, i dipoli istantanei ed i ponti salini (che invece sono interazioni di tipo idrofilico).
Per quanto riguarda le forze di Van Der Waals ricordiamo che la loro forza dipende dalla superficie dell’interazione. Nelle proteine in forma nativa (ovvero funzionante) le ritroviamo spesso come interazioni all’interno della struttura proteica stessa (interazioni intraproteiche). Invece quando la proteina viene denaturata (come avviene spesso degli alimenti processati), l’esposizione delle parti idrofobiche all’ambiente esterno promuove le interazioni di Van der Waals tra catene polipeptidi che diverse (interazioni interproteiche). Questo fenomeno è alla base delle aggregazioni proteiche che avvengono in prodotti trattati termicamente e che portano alla formazione di gel e di schiume.
Per quanto riguarda i dipoli e i ponti salini c’è da dire che sono fortemente dipendenti dall’ambiente esterno (forza ionica e pH del mezzo). Modulando opportunamente il mezzo possiamo modificare queste interazioni in modo da cambiare le proprietà delle proteine alimentari (marinature, processi di salatura ecc)
La denaturazione è il processo opposto al folding: Si ha la perdita della struttura secondaria e terziaria. La perdita della struttura primaria è invece molto più difficile: In questo caso sono responsabili o degli enzimi peptidici o un processo di idrolisi acida/basica ad hoc.
La denaturazione può essere determinata da vari fattori: PH, temperatura, forza ionica, stress meccanico, pressione osmotica. Per cui molti processi tecnologici come la cottura, il congelamento, l’essiccazione, l’irraggiamento portano alla denaturazione. E’ fondamentale conoscere i principi generali della denaturazione e le caratteristiche specifiche delle principali proteine alimentari in modo da poterla regolare ed indirizzare a proprio piacimento, al fine di ottenere determinate caratteristiche nel prodotto voluto.
Gli alimenti ricchi in proteine sono:
La quantità (così come il tipo) di proteine determina fortemente le caratteristiche fisiche e sensoriali del prodotto.
Solitamente si stima il valore nutrizionale delle proteine solo in funzione della percentuale di AA essenziali che essa contiene. In realtà, i parametri da considerare in questa stima sono due: presenza degli AA essenziali e biodisponibilità.
Gli amminoacidi essenziali sono quelli che un organismo non è in grado di sintetizzare da sé in quantità sufficiente, ma che deve assumere con l’alimentazione. I principali amminoacidi essenziali sono la lisina e gli AA contenenti zolfo, ovvero la cisteina e la metionina.
La biodisponibilità dipende della digeribilità della proteina ovvero dalla facilità con cui vengono idrolizzati i legami peptidici rendendo assimilabili i peptidi e gli amino acidi che la compongono. Le proteine animali, anche quelle dei derivati, sono più facilmente denaturabili e digeribili rispetto a quelle vegetali. La biodisponibilità dipende molto dalla suscettibilità alla denaturazione e anche al livello di modificazioni post tradizionali e alle derivatizzazioni indotte dai processi termici. La biodisponibilità delle proteine vegetali, che sono in genere molto resistenti alla denaturazione , migliora molto con i processi. Invece, in prodotti in cui un’estesa Reazione di Maillard provoca una reticolazione delle proteine la biodisponibilità delle proteine coinvolte (non solo degli amminoacidi direttamente coinvolti nella reazione) diminuisce.
Cosa succede alle proteine una volta introdotte nel nostro corpo?
In primis si ha una loro parziale o totale denaturazione per via dell’acidità dei succhi gastrici. A livello gastrico e poi intestinale le proteasi umane (pepsina, tripsina, chimotripsina, peptidasi) scindono le proteine in oligopeptidi fino a produrre di e tri peptidi. Questi stessi vengono poi assorbiti dalla mucosa intestinale e poi scissi in singoli AA che verranno utilizzati per la sintesi di nuove proteine.
Ci sono però delle eccezioni: alcuni oligopeptidi e proteine di grandi dimensioni possono passare direttamente tramite le “tight junction” intestinali (vedi immunoglobuline del colostro, prioni o peptidi delle gliadine responsabili della celiachia).
Come accennato precedentemente alcuni processi diminuiscono la digeribilità proteica facendo arrivare a livello intestinale dei grossi peptidi, i quali sono substrato ottimale della microflora proteolitica (ad esempio i clostridi), il che è in genere una cosa negativa per il bilancio dei batteri nell’intestino.
Cosa succede quando, come avviene frequentemente nella diete occidentali, si ha un introito proteine superiore al fabbisogno? Gli AA delle proteine in eccesso vengono transaminati ed utilizzati nei cicli catabolici per produrre energia. L’ammoniaca che si forma viene eliminata attraverso il ciclo dell’urea (cosa che determina un affaticamento del metabolismo)
Negli alimenti, le proteine influenzano fortemente le proprietà strutturali. Le loro tre caratteristiche fondamentali che vanno ad influenzare la struttura di un prodotto sono:
In un alimento contenente proteine non denaturate (native) la maggior parte delle interazioni sono intramolecolari. Questa situazione cambia in due casi: Quando si arriva al punto isoelettrico e quando si denaturano le proteine.
Per quanto riguarda il punto isoelettrico, ricordiamo che al punto isoelettrico la carica delle proteine è nulla e, se le cariche sono nulle, le proteine aggregano vista la nulla repulsione elettrostatica e la maggiore idrofobicità (diminuzione della solubilità in acqua).
Per quanto riguarda la denaturazione diciamo che, nel momento in cui una proteina viene denaturata, la struttura terziaria si apre e le interazioni che erano INTRAmolecolari possono diventare INTERmolecolari. Ma perché abbiamo la formazione di questi nuovi legami che portano ad una aggregazione più o meno forte? E’ una questione di energia libera: Le proteine, una volta “aperte”, devono “nascondere” la loro componente apolare all’ambiente acquoso e quindi si aggregano tra di loro.
Qualunque sia la loro natura, le interazioni tra proteine sono fondamentali per conferire specifiche caratteristiche organolettiche agli alimenti come aspetto, consistenza, texture, viscosità nonché per ottenere determinate proprietà strutturali in caso di gel, schiume, emulsioni, etc. Per questo i processi di trasformazione degli alimenti (in primis la cottura, ma anche molti trattamenti meccanici o l’inserimento di gas nel sistema) che modificano queste interazioni cambiano in modo profondo le proprietà e le caratteristiche dei suddetti alimenti. Ovviamente il processo deve essere strettamente controllato in modo da ottenere le caratteristiche finali desiderate.
Si tratta di modifiche a carico dei gruppi R.
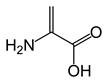
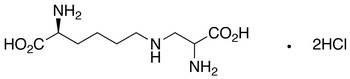
Deidroalanina Lisino alanina
Fonte: https://www.docenti.unina.it/downloadPub.do?tipoFile=md&id=271034
Sito web da visitare: https://www.docenti.unina.it/
Autore del testo: Prof. Fogliano Vincenzo
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve