I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
DETERMINISMO E STATISTICA
Con la fisica quantistica viene a cadere il concetto di grandezze che variano con continuità. L'elettrone può muoversi solo su orbite di raggio ben definito e l'energia elettromagnetica che l'atomo scambia con il mondo esterno avviene solo per quantità discrete (quanto di energia o fotone). Vedremo ora che la fisica moderna mette in discussione anche uno dei metodi di ragionamento caratteristici della fisica classica: il metodo deterministico a favore del metodo statistico, vediamo di cosa si tratta.
Consideriamo un sistema fisico cioè un insieme di corpi che partecipano a un certo fenomeno. Ad esempio osserviamo un'automobile che viaggia con velocità costante. In tal caso il sistema è costituito dall'automobile e dalla strada. Ipotizziamo che il nostro sistema sia isolato cioè che i corpi contenuti nel sistema non subiscano influenze da parte di agenti esterni.
Definire lo stato di un sistema ad un determinato istante significa eseguire un insieme di misure; possiamo, ad esempio, misurare la velocità dell'automobile (20 m/s) e la sua posizione. Ci domandiamo: "è possibile prevedere quale sarà lo stato del sistema dopo un certo intervallo di tempo?" Sì, se conosciamo la legge che governa il sistema ! Infatti dalla legge oraria del moto rettilineo uniforme stabiliamo che dopo 6 secondi l'automobile avrà percorso metri…..
Possiamo così formulare il concetto su cui si basa l'idea deterministica (detta anche meccanicistica). " Se conosciamo lo stato iniziale di un sistema e le leggi che lo governano, possiamo prevedere quale sarà lo stato del sistema in un arbitrario istante successivo (ed anche il suo passato)"
Alla metà del secolo XIX si riteneva che il metodo deterministico di indagine costituisse l'essenza stessa della fisica che potesse permettere di risolvere ogni tipo di problema anche i più complessi. Si pensava che se si riusciva a conoscere lo stato dell'Universo (Stelle, Terra, popoli, noi stessi) e le leggi che lo governano in un certo istante si potesse prevedere il suo sviluppo nei più piccoli dettagli.
Maxwell e Boltzmann, tuttavia, indagando il comportamento dei gas si resero conto che il metodo deterministico non sempre era applicabile. Un gas, come l'aria che respiriamo, è composto da un'enorme quantità di particelle che si muovono rapidamente in ogni direzione rimbalzando sulle pareti del recipiente dove è rinchiuso. Se volessimo applicare il metodo meccanicistico alla descrizione del moto delle particelle dovremmo misurare in tempi brevissimi la posizione iniziale e le velocità di 6x1023 (numero di Avogadro) particelle per cm3 ! Cosa impossibile!
Pertanto si deve sostituire il metodo deterministico con il metodo statistico che non richiede la conoscenza dettagliata degli stati iniziali di ogni singola particella. Ma, naturalmente, dobbiamo pagare un prezzo corrispondente a questa non conoscenza degli stati iniziali e questo è da riscontrarsi nel fatto che non possiamo prevedere lo stato finale del sistema. Quello che potremo fornire saranno soltanto valori medi che caratterizzano l'intero sistema.
Non possiamo conoscere qual è la velocità di una singola molecola, siamo però in grado di dire qual è la velocità più probabile, cioè la velocità posseduta dal maggior numero di molecole. Il diagramma ci permette di concludere anche che la probabilità di trovare molecole dotate di alta e bassa velocità è piccola, ma comunque non nulla. In sostanza le velocità si distribuiscono attorno alla velocità media secondo una certa regola detta "legge delle distribuzione delle velocità di Maxwell-Boltzmann" definita dalla seguente formula:
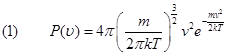
La quantità P(v) è una funzione detta di distribuzione definita nel seguente modo:
Il prodotto P(v)Dv(che è una quantità adimensionale) è la frazione di molecole le cui velocità sono comprese tra v e v+Dv.
Pertanto, la situazione agli inizi del XX° secolo era questa: quando si considerano pochi corpi si usano i metodi deterministici e quando il sistema è costituito da un numero molto alto di individui si utilizzano i metodi statistici, che ci permettono di ottenere risultati sul futuro di un sistema in modo meno esatto e completo. Mostreremo ora che anche quando si studia il mondo dell’infinitamente piccolo cioè quello degli atomi e dei nuclei si devono sempre utilizzare metodi statistici, nel senso che le leggi che governano questo mondo sono governate da leggi di probabilità, anche quando il numero di particelle che studio è limitato!
Ad esempio Heisenberg e Born nel 1926 hanno stabilito che la teoria di Bohr (1911) che assegnava traiettorie circolari agli elettroni non è del tutto corretta poiché si è scoperto che l'elettrone si muove all'interno dell'atomo in tutte le direzioni senza seguire delle traiettorie precise. Heisemberg definì una regola nota come Principio di indeterminazione che può essere così enunciata: "E' impossibile conoscere con precisione, in un dato momento, la posizione (coordinate) e la quantità di moto (e quindi la velocità) di una particella. In particolare l’indeterminazione (errore assoluto o incertezza) sul valore della quantità di moto Dpx e l’indeterminazione sulla posizione Dx sono legate dalla relazione:
![]()
Quindi se si vuole rendere piccola l’incertezza nella determinazione della posizione di una particella necessariamente aumenta l’errore nella valutazione della sua velocità. Ciò è in netto contrasto con la meccanica classica dove è sempre possibile definire simultaneamente sia la posizione che la velocità di un oggetto e quindi stabilirne la traiettoria. Questa discrepanza tra mondo macroscopico e mondo microscopico è dovuta al fatto che quando vado a fare delle misure di velocità e di posizione di un corpo in movimento lo devo illuminare con dei fotoni. Un fotone trasporta con se energia e quantità di moto e pertanto perturba la traiettoria se l’oggetto è particolarmente piccolo (come nel caso delle particelle del mondo atomico) cosicché non è possibile effettuare la misura con la precisione elevata. Invece se il corpo ha dimensioni notevoli si possono trascurare gli effetti della luce che serve per illuminarlo!
Es 1: La velocità di un pallino da caccia di massa m = 0.1 g è determinata con una precisione Dv = 10-8 m/s. Calcolare l’incertezza nella determinazione della posizione. R: Dx = 10-22 m
Come si vede, la posizione del pallino è determinata con estrema precisione. Pertanto per i corpi macroscopici, il principio di indeterminazione non ha alcun interesse pratico!
Es 2: Secondo la concezione classica l’elettrone si muove attorno al nucleo con una velocità di 106 m/s. Le dimensioni dell’atomo sono dell’ordine di 10-10 m. E’ perciò lecito pensare che nel caso più sfavorevole si possa determinare le sue coordinate con una precisione prossima alle dimensioni dell’atomo, ossia Dx = 10-10 m. Determinare in queste condizioni l’incertezza sulla velocità. (R: Dv » 106 m/s). Come si vede l’incertezza sulla determinazione della velocità dell’elettrone è dello stesso ordine di grandezza della velocità con cui esso si muove nell’atomo!
Una conseguenza del principio di indeterminazione è che un elettrone non si muove attorno all’atomo su una traiettoria ben definita ma tende a muoversi in una certa zona intorno al nucleo, la cui forma dipende principalmente dal livello energetico dell'elettrone, definita orbitale atomico che è la regione di spazio intorno al nucleo in cui la probabilità di trovare l'elettrone è molto alta.
Es3: Il luogo in cui è più facile incontrare la studentessa ………………della , in una mattina di un giorno feriale di maggio è la scuola. Allora l'orbitale atomico di…………….è l'edificio scolastico. Non siamo però sicuri di incontrarla perché può subentrare un fatto eccezionale quale una malattia o un impegno familiare o altro. Vi è un'alta probabilità di trovarla al Greppi, ma non vi è la certezza!
Il grafico mostra la probabilità (radiale) di trovare l'elettrone di un orbitale di tipo s (simmetria sferica)in un punto qualsiasi a distanza r dal nucleo.
La "funzione di distribuzione" della probabilità radiale dell'elettrone nello stato 1s dell'idrogeno
La probabilità di trovare l'elettrone ad una distanza compresa tra r e r+Dr è P(r)Dr.
Da notare la forte somiglianza tra la (1) e la (3)!
Concludiamo: la fisica classica era costruita solidamente sull'idea che la natura seguisse delle leggi ben precise, deterministiche o causali. Se si avevano conoscenze sufficienti circa un corpo o un'onda luminosa o un qualsiasi sistema ad un dato istante, il loro comportamento futuro era calcolabile esattamente. Non vi erano problemi nella determinazione della traiettoria percorsa dalla Luna o dai pianeti nel cielo. Era possibile costruire un ponte con la piena certezza che non sarebbe precipitato a causa di qualche fluttuazione imprevedibile delle leggi della meccanica. Il completo determinismo delle leggi naturali ebbe un effetto notevole sulla filosofia del secolo XIX° e si riflette sull'immagine popolare di un universo che poteva essere considerato come un gigantesco meccanismo, "la macchina dell'universo", la quale svolge inevitabilmente e implacabilmente il film della storia secondo un piano predeterminato.
Ciononostante siamo consapevoli che è necessario ricorrere all'uso dei metodi statistici e quindi del concetto di media e probabilità per studiare certi fenomeni, anche della vita quotidiana, senza bisogno di spingerci nel mondo dell' infinitamente piccolo.
Come ben sanno gli assicuratori quando stipulano polizze sulla vita o i giocatori d'azzardo, la vita e la morte e le ruote della roulette sono governate da leggi probabilistiche.
Questo fatto ci porta a un punto critico. La probabilità del mondo macroscopico e nella fisica classica è una probabilità di ignoranza; la probabilità nel mondo microscopico è una proprietà fondamentale della natura. L'unica ragione per cui non può essere calcolata in anticipo la casella nella quale va a finire la pallina di una roulette è l'ignoranza di quelle che il fisico chiama "condizioni iniziali'.
Se il giocatore conoscesse ogni particolare meccanico della ruota, le dimensioni, la massa e la velocità di lancio della pallina, la legge degli attriti nei supporti, egli potrebbe in linea di principio prevedere il risultato del lancio. Così come potrebbero 1023 ultraveloci e meticolosi sperimentatori prevedere la posizione delle molecole del gas contenuto in un recipiente della capacità di 1cm3.
La differenza nella legge di probabilità della meccanica quantistica sta nel fatto che non è possibile, né in linea di principio né di fatto , calcolare l'andamento esatto di un evento atomico, non importa con quanta precisione siano note le condizioni iniziali.
Ad esempio, con il contatore Geiger possiamo rilevare le radiazioni ¡ e le particelle a emesse da isotopi radioattivi (Ra22688) mescolati nella sostanza fosforescente presente sulle lancette di un vecchio orologio.
Quando si compie un esperimento come questo, si è incredibilmente vicini al mondo microscopico. Il singolo “clic” che si ode significa che tra gli infiniti miliardi di atomi sulla superficie delle lancette dell'orologio, un nucleo ha improvvisamente espulso una particella a dotata di alta velocità trasformandosi in un nucleo diverso (Rn22286).
Si verifica che i clic udibili delle disgregazioni radioattive non si presentano in una sequenza regolare ma si susseguono secondo un ritmo casuale.
Quindi, secondo la meccanica quantistica, si possono conoscere tutti i fatti possibili che ci sono da conoscere su un isotopo e non essere in grado di prevedere quando esso decadrà. Possiamo soltanto affermare che in un tempo pari al tempo di dimezzamento (1600 anni!) la metà degli isotopi presenti saranno decaduti. Sul singolo isotopo possiamo affermare che ha una probabilità pari a 1/2 che il suo nucleo decada in un tempo pari al tempo di dimezzamento.
A questo punto rimane un dilemma!. La probabilità del mondo microscopico è realmente una proprietà fondamentale della natura o forse, dopo tutto, è una probabilità di ignoranza , che nasce da una struttura della materia complicata, più profonda e ancora misteriosa ? Einstein, spesso in contrasto con le idee della meccanica quantistica, amava osservare che non credeva che Dio giocasse ai dadi, e nel 1953 egli scrisse: " Secondo me è profondamente insoddisfacente basare la fisica su una tale prospettiva teorica, poiché l'abbandono della possibilità di una descrizione oggettiva… non può far altro che risolvere in nebbia l'immagine del mondo fisico che ci si è costruiti".
Fonte: http://www.fisicaweb.org/doc/fisica%20moderna/determinismo%20e%20stat..doc
Sito web da visitare: http://www.fisicaweb.org/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve