I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Il fenomeno dell'osmosi si produce ogniqualvolta due soluzioni a diversa concentrazione sono separate da una membrana semipermeabile (selettivamente permeabile), che permette il passaggio selettivo (diffusione) solo di alcuni componenti la soluzione e non di altri.
Analizziamo il caso più semplice in cui una soluzione contenente un unico soluto è separato dall’acqua pura attraverso una membrana semipermeabile.Il soluto non è in grado di diffondere ed attraversare la membrana, mentre il solvente diffonde liberamente.
1) Poiché il movimento di diffusione del soluto è impedito dalla presenza della membrana semipermeabile, l'unico movimento consentito è quello del solvente (acqua). Le molecole di solvente si muovono naturalmente nei due sensi, ma inizialmente la probabilità che l’acqua entri nella soluzione è maggiore di quella che esca. Finchè la velocità di entrata Ve è maggiore della velocità di uscita Vu, il movimento netto del solvente in entrata contribuisce a diluire la soluzione e ne fa alzare il livello, mentre il livello dell’acqua pura esterna si abbassa. Il fenomeno è noto come osmosi. Il flusso dell’acqua in entrata genera dunque una pressione, in grado di far aumentare il livello della soluzione, detta pressione osmotica. |
2) Man mano che la soluzione si diluisce (ed aumenta dunque in essa la quantità di solvente) aumenta la probabilità che le molecole d’acqua escano dalla soluzione. Il fenomeno esmotico raggiunge un punto di equilibrio quando la velocità dell’acqua in entrata eguaglia la velocità dell’acqua in uscita. Il livello della soluzione si alza fino a quando al punto in cui la pressione esercita dalla colonna di liquido innalzatasi fa esattamente equilibrio alla pressione esercitata dal solvente in entrata. Quando viene raggiunto l'equilibrio è quindi possibile utilizzare il peso della colonna d'acqua come misura della pressione esercitata dal solvente in entrata, o pressione osmotica, π. Si ricordi che il metro d’acqua (come il mm di Hg) è una unità di misura di pressione (1 atm = 10 m H2O = 760 mm Hg) |
Sperimentalmente si osserva che la pressione osmotica prodotta da una soluzione rispetto al solvente puro obbedisce all'equazione di stato dei gas perfetti
![]()
dove V = volume della soluzione ed n = numero di moli di soluto
Tenendo conto poi che n/V è la molarità della soluzione, la relazione diventa
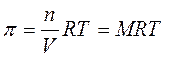
La pressione osmotica di una soluzione, a temperatura costante, dipende dunque esclusivamente dalla sua concentrazione.
Nel caso si prendano in considerazione 2 soluzioni a diversa concentrazione, la pressione osmotica è proporzionale alla differenza di concentrazione DM.
![]()
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve