I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
TRASFORMAZIONI TERMODINAMICHE
Tutte le proprietà di un gas sono perfettamente descritte da tre coordinate termodinamiche, pressione (p), temperatura (T) e volume (V), più la quantità di materia che esso contiene (numero di moli, n)
Un gas si trova allo stato di equilibrio termodinamico quando le tre grandezze che lo caratterizzano sono costanti nel tempo: un gas tenuto in un recipiente chiuso, isolato dall'esterno si trova allo stato di equilibrio. Se però il recipiente che contiene il gas è chiuso da un pistone, alzando o abbassando il pistone il gas subirà una trasformazione termodinamica, dove la sua pressione varia (aumenta o diminuisce) e solo dopo un determinato periodo di tempo si ristabilisce l'equilibrio. Una trasformazione termodinamica è caratterizzata perciò dal passaggio di un gas da uno stato iniziale (che chiameremo A) a uno stato finale (che chiameremo B), attraverso una successione di stati intermedi.
Le trasformazioni termodinamiche sono alla base degli scambi di energia dovuti ai gas (e non solo ai gas, ma noi tratteremo solo quelli dei gas): infatti, tutte le volte che un gas scambia calore (cioè assorbe/cede calore) o quando un gas esegue un Lavoro (espansione se il gas applica il Lavoro all’esterno, contrazione se è l’esterno ad applicare Lavoro al gas) si ha necessariamente una trasformazione termodinamica, cioè un cambiamento di almeno una delle tre coordinate del gas. Vale anche il viceversa: se un gas cambia almeno una delle sue coordinate (pressione, volume, temperatura) allora necessariamente c’è uno scambio di calore o di Lavoro. In conclusione:
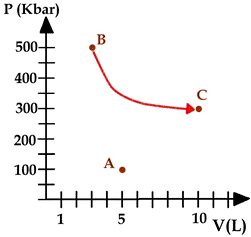
Una trasformazione termodinamica viene in genere rappresentata su un piano cartesiano riportando in ascissa i valori del volume V e in ordinata i valori della pressione p del gas. Un sistema in equilibrio è rappresentato da un punto nel piano pressione-volume ( piano V-p o piano di Clayperon), mentre una trasformazione è rappresentata da una linea, o da una successione di linee, che porta il sistema da un punto a un altro (v. figura 1).
Una trasformazione termodinamica può avvenire in modo che una delle tre coordinate rimanga costante: si parla di trasformazione isotermica se la temperatura rimane costante durante il processo, di trasformazione isobara se avviene a pressione costante e di trasformazione isocora (o isometrica) se avviene a volume costante. Infine, una trasformazione termodinamica che avviene senza che avvengano scambi di calore tra il sistema e l'ambiente circostante, si dice adiabatica.
Studiare una trasformazione termodinamica vuol dire essere in grado di prevedere quali saranno i valori finali di p, T, V una volta noti quelli iniziali ed il tipo di trasformazione effettuato e poter calcolare qual è il calore ed il Lavoro scambiato durante la trasformazione.
Se il gas è perfetto (condizione che racchiude praticamente ogni gas nella nostra atmosfera con l’unica eccezione del vapor d’acqua quando è vicino alla condensazione), alla base di ogni trasformazione termodinamica ci sono le leggi del gas perfetto, descritte in altri appunti . Per comodità le riassumo brevemente.
Leggi del gas perfetto
In formule: P×V = cost (T cost.)
in una trasformazione a pressione costante (isobara) la pressione è proporzionale alla temperatura in Kelvin (1° Legge di Gay-Lussac)
In formule: p1/T1 = p2/T2 (V cost) , con la temperatura espressa in Kelvin.
In formule: V1/T1 = V2/T2 (p cost) , con la temperatura espressa in Kelvin.
In formule: p a n (p e V cost e di conseguenza anche T cost)
Tutte queste quattro leggi sono raggruppabili in un’unica equazione che lega insieme p,V,T,n: tale equazione si chiama equazione di stato dei gas perfetti:
p×V = n×R×T , T in kelvin
R è la costante dei gas perfetti, il cui valore risulta essere [ R = 8,314472 (pressione in Pascal, volume in m3) o alternativamente R=0,08205784 (pressione in atm, volume in litri=dm3) ]
Adesso risolveremo alcuni semplici problemi per impratichirci delle proprietà essenziali delle trasformazioni termodinamiche: ci concentreremo soltanto su come cambiano le coordinate di un gas p , V , T senza preoccuparci degli scambi di energia: quest’ultimi saranno accennati in seguito, quando ci saremo impratichiti dei concetti fondamentali delle trasformazioni termodinamiche.
PROBLEMI INTRODUTTIVI
È interessante iniziare a studiare delle trasformazioni di stato particolari, dove si mantiene costante, durante la trasformazione, una delle tre variabili di stato.
Trasformazione isocora o isometrica (V = costante)
Si ha quando durante la trasformazione del gas tra due stati di equilibrio, si mantiene costante il volume. Per una trasformazione isocora si applica la 1° legge di Gay-Lussac: p1/T1 = p2/T2
Supponiamo di avere un gas chiuso dentro un recipiente sigillato (a volume costante di 5 litri) alla pressione p=200 kPa (1kPa = 1000 Pa) e alla temperatura T=20°C; se lo riscaldo alla temperatura di 300 °C , quale sarà la sua pressione?
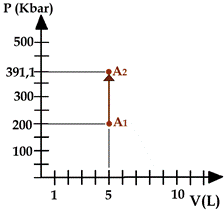 Soluz: Applico la 1° legge di Gay-Lussac: p1/T1 = p2/T2; p1=200kPa , T1=20°C , T2=300°C.
Soluz: Applico la 1° legge di Gay-Lussac: p1/T1 = p2/T2; p1=200kPa , T1=20°C , T2=300°C.
Poiché la legge di Gay-Lussac è scritta per la temperatura in Kelvin, trasformo i gradi Celsius in Kelvin. TKELVIN = TCELSIUS + 273,15 , che arrotondo per comodità a TKELVIN = TCELSIUS + 273,15
T1 = 20+273 = 293K ; T2 = 300+273 = 573K ®
p1/T1 = p2/T2 ® 200kPa/293 = p2/573 ® p2=391,1kPa
Trasformazione isobara (p = costante) Si ha quando durante la trasformazione del gas tra due stati di equilibrio, si mantiene costante la pressione. La trasformazione segue la legge V1/T1 = V2/T2.
 Supponiamo di avere un gas aperto all’aria, soggetto perciò alla pressione costante di circa 100.000 Pa (100 kPa); supponiamo che alla temperatura di 200°C esso occupi un volume di 8 litri. Se raffreddo il gas portandolo alla temperatura di -15°C, quale sarà il suo volume finale?
Supponiamo di avere un gas aperto all’aria, soggetto perciò alla pressione costante di circa 100.000 Pa (100 kPa); supponiamo che alla temperatura di 200°C esso occupi un volume di 8 litri. Se raffreddo il gas portandolo alla temperatura di -15°C, quale sarà il suo volume finale?
Soluz: Applico la 2° legge di Gay-Lussac: V1/T1 = V2/T2; V1=8 litri , T1=18°C , T2=-15°C.
TKELVIN = TCELSIUS + 273,15 , che arrotondo per comodità a TKELVIN = TCELSIUS + 273
T1 = 200+273 = 473K ; T2 = -15+273 = 258K ®
V1/T1 = V2/T2 ® 8litri/473 = V2/258 ® V2=4,36 litri
Tale relazione, nel piano (V - p) è rappresentata da una retta parallela all’asse dei Volumi (asse orizzontale).
Trasformazione isoterma (T = costante) Si ha quando durante la trasformazione del gas tra due stati di equilibrio, si mantiene costante la temperatura. E’ tipica di trasformazioni lente che hanno il tempo di scambiare calore con l’esterno per mantenere sempre costante la loro temperatura. La compressione o la dilatazione del gas dentro una siringa è una tipica trasformazione isoterma se lo stantuffo è mosso lentamente.
Per una trasformazione isoterma vale la legge di Boyle-Mariotte: p×V = costante = n×R×T
All’aumentare del volume diminuisce la pressione e viceversa al diminuire del volume aumenta la pressione, in modo che il prodotto p⋅V rimanga sempre lo stesso.
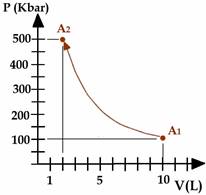 Supponiamo che un gas occupi un volume di 10 litri alla pressione atmosferica (100 kPa): esso viene compresso lentamente fino a giungere al volume di 2 litri: qual è la sua pressione se la trasformazione è stata isoterma?
Supponiamo che un gas occupi un volume di 10 litri alla pressione atmosferica (100 kPa): esso viene compresso lentamente fino a giungere al volume di 2 litri: qual è la sua pressione se la trasformazione è stata isoterma?
Soluz: Applico la legge di Boyle-Mariotte: p×V = cost; p1=100kPa , V1=10 litri ; V2=2 litri Non ho bisogno di alcuna conversione: applico subito la legge:
p1V1 = p2V2 ® 100kPa×10L = p2×2L ® p2=500kPa
 Tale relazione, nel piano (V - p) è rappresentata da una iperbole equilatera: inversamente, se un gas si trasforma in modo da seguire un’iperbole equilatera nel grafico p-V allora la sua temperatura è rimasta costante.
Tale relazione, nel piano (V - p) è rappresentata da una iperbole equilatera: inversamente, se un gas si trasforma in modo da seguire un’iperbole equilatera nel grafico p-V allora la sua temperatura è rimasta costante.
Trasformazione generica (tratto da “Fisica”, di J. Walker)
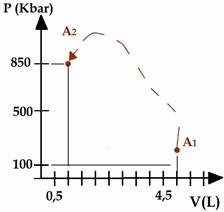 Adesso confideremo una trasformazione generica, cioè che non rientra in nessuna delle tre categorie considerate. Per studiarla applicheremo perciò l’equazione più generale: quella di stato dei gas perfetti.
Adesso confideremo una trasformazione generica, cioè che non rientra in nessuna delle tre categorie considerate. Per studiarla applicheremo perciò l’equazione più generale: quella di stato dei gas perfetti.
Considera di avere una bombola d’aria compressa che contiene 0.5 m3 di aria a temperatura 285 K e pressione 850 kPa. Calcola che volume occuperebbe quest’aria se fosse rilasciata nell’atmosfera dove la pressione è 101 kPa e la temperature di 303 K.
 Soluz: Lo stato iniziale del gas viene descritto attraverso la pressione, il volume e la temperatura. Della situazione finale conosciamo, invece, la pressione e la temperatura. Non essendo specificato il tipo di trasformazione, l’unica equazione che si è legittimati ad usare è quella dei gas perfetti: pV=nRT
Soluz: Lo stato iniziale del gas viene descritto attraverso la pressione, il volume e la temperatura. Della situazione finale conosciamo, invece, la pressione e la temperatura. Non essendo specificato il tipo di trasformazione, l’unica equazione che si è legittimati ad usare è quella dei gas perfetti: pV=nRT
Essendo R una costante nota, i parametri che non si conoscono sono il volume finale e il numero di moli n.
Calcolo di n: utilizzando l’equazione dei gas perfetti, applicata alle informazioni sulle condizioni iniziali, è possibile ottenere il numero di moli: n = p1V1/RT1
Poiché il numero n è l’unica quantità che rimane invariata prima e dopo (la quantità di gas non si crea né si distrugge), si può trovare il volume attraverso la relazione: V2 = nRT2/ P2
Ottenendo il seguente risultato: V2 =4,5 m3
Dato che il tipo di trasformazione non è specificato, non sappiamo come unire i due punti A1 e A2 nel piano V-p: la possibile trasformazione potrebbe essere quella tratteggiata ma anche qualsiasi altra unente i due punti.
PROBLEMI PERFETTI
Adesso ci eserciteremo a risolvere alcuni semplici problemi riguardanti le trasformazioni dei gas perfetti.
Problema1: la trasformazione isoterma (tratto da “Lineamenti di Fisica”, di P. Alberico)
Un gas perfetto, alla pressione di 3 atmosfere, occupa un volume di 30 dm3. Di quanto si deve espandere, a temperatura costante, per portarsi alla pressione normale di 1 atmosfera?
Soluz: Dato che la trasformazione avviene a temperatura costante (isoterma) è possibile utilizzare la legge di Boyle-Mariotte: p1V1 = p2V2
Di questa relazione si conoscono la pressione ed il volume iniziali e, anche, la pressione finale.
Utilizzando direttamente questa relazione è possibile trovare il valore del volume finale da cui poi dedurre di quanto si è dovuto espandere. In particolare:
p1V1 = p2V2 ® 3atm×30dm3 = 1atm×V2® V2 = 90dm3
Nota sulle unita di misura: nel fare i calcoli non sono stati necessari cambiamenti di unità di misura essendo tutte le grandezze espresse son le solite unità di misura.
Problema2: le due trasformazioni. Una data massa di gas che a 0°C occupa un volume di 10 litri ed ha una pressione di 5 atm viene riscaldato a 150 °C. Calcolare: a) il volume occupato dal gas se si mantiene costante la pressione; b) la pressione esercitata dal gas se si mantiene costante il volume
Soluz:
a) Applichiamo la prima legge di Gay Lussac: V1/T1= V2/T2 dopo aver operato le opportune conversioni della temperatura:
Sostituiamo i valori noti nella relazione V1/T1= V2/T2
10L/273K = V2/423K ® V2 = 15.5 L
b) Applichiamo la seconda legge di Gay Lussac: p1/T1= p2/T2
5atm/273K = p2/423K ® p2 = 7,75 atm
Problema3: isobara. Una data massa di gas occupa a 20 °C il volume di 0,05 m3. Calcolare a quale temperatura espressa in gradi Kelvin occorre portare il gas affinché il volume diventi 100 L a pressione costante.
Soluz:
Applichiamo la prima legge di Gay Lussac: V1/T1= V2/T2 , dopo aver operato le opportune conversioni della temperatura e del volume: T1 = 20 + 273 = 293 K
0,05 m3 = 50 dm3 = 50 L
Sostituiamo i valori noti nella relazione V1/T1= V2/T2
50L/293K = 100L/T2 ® T2 = 586 K = (586-273) = 313°C
Problema4: trasformazione generica. Alla temperatura di 127 °C un gas contenuto in un recipiente di 2 L esercita una pressione di 3 atm (300.000Pa). Calcolare quale volume occupa il gas alla pressione d 1 atm (100.000 Pa) e alla temperatura di 0 °C
Soluz: Applichiamo la legge di stato dei gas: pV=n×R×T
Per conoscere il volume finale (V2) devo per prima cosa calcolare il numero di moli n e poi calcolare V2.
Calcolo di n: utilizzando l’equazione dei gas perfetti, applicata alle informazioni sulle condizioni iniziali, è possibile ottenere il numero di moli: n = p1V1/RT1 ® n=0,18 moli
Poiché il numero n è l’unica quantità che rimane invariata prima e dopo (la quantità di gas non si crea né si distrugge), si può trovare il volume attraverso la relazione: V2 = nRT2/ P2
Tutte le temperature devono essere espresse in Kelvin: T1=127+273=400K ; T2=0+273=273K.
Ottenendo il seguente risultato: V2 =4,085 m3
Problema5: i disegnini. Disegna sul grafico V-p queste trasformazioni:
Soluz: i grafici sono mostrati sotto

Problemi estratti dal sito: “http://www.chimicamo.org/stechiometria/esercizi-svolti-sui-gas.html”
Potete trovare altri problemi svolti all’indirizzo” http://www.uniroma2.it/didattica/Chimica-Medica/deposito/es._gas.pdf”
Il gas perfetto e le sue leggi è introdotto negli appunti “TERMODINAMICA – cenni”
Fonte: http://digilander.libero.it/amaccioni1/Documenti/U_Trasformazioni%20Termodinamiche.doc
Sito web da visitare: http://digilander.libero.it/amaccioni1
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve