I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Prima di procedere al bilanciamento è ovviamente necessario verificare che la reazione sia effettivamente una "redox". E' cioè necessario verificare che almeno due elementi abbiano subito durante la reazione dei cambiamenti nei numeri di ossidazione.
Ciò risulta particolarmente evidente quando un elemento si trova da un lato della linea di reazione allo stato elementare (nox = 0) e dall'altro si trova legato all'interno di un composto (nox ≠ 0).
In tutti gli altri casi è necessario calcolare i numeri di ossidazione, scrivendo i numeri di ossidazione variati sopra i rispettivi elementi.
1) Calcolo elettroni ceduti/acquistati. Si uniscono con una freccia gli atomi dell'elemento che si ossida e con un'altra gli atomi dell'elemento che si riduce, individuando in tal modo le semireazioni di ossidazione e di riduzione. In corrispondenza di ciascuna freccia si scrive il numero di elettroni persi ed acquistati, calcolato come prodotto tra la variazione (in aumento o in diminuzione) del numero di ossidazione (Δnox), ed il numero di atomi (indice) dell'elemento che reagisce.
Nell’esempio che segue:
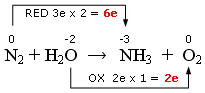
In altre parole i due atomi di azoto che si riducono, acquistando ciascuno 3 elettroni, catturano complessivamente 6 elettroni, mentre l'atomo di ossigeno presente nell'acqua, che si ossida, perde in tutto due elettroni.
2) Scrittura semireazioni e bilancio di massa - Si scrivono le due semireazioni di riduzione e di ossidazione. Si bilanciano gli elementi che si ossidano e che si riducono (bilancio di massa). Nel caso in cui il bilancio di massa implichi una variazione del coefficiente che precede un reagente è necessario moltiplicare per lo stesso numero anche gli elettroni trasferiti nella semireazione, aggiornando il numero di elettroni persi o acquistati.
N2 + 6e → NH3
(riduzione)
H2O → O2 + 2e
(ossidazione)
In questo caso:
N2 + 6e → 2NH3
2H2O → O2 + 4e
3) Calcolo del rapporto di scambio elettronico e bilancio elettronico - Si calcola il rapporto di scambio elettronico tra la specie che si riduce e quella che si ossida (rapporto tra elettroni acquistati ed elettroni ceduti). In questo caso il rapporto sarà 6/4 = 3/2. In altre parole per ogni 3 elettroni assorbiti dalla semireazione di riduzione, 2 elettroni vengono ceduti dalla semireazione di ossidazione. Si utilizzano numeratore e denominatore del rapporto di scambio per moltiplicare, in croce, entrambi i membri delle due semireazioni.. In altre parole si usa il numero trovato in una semireazione per moltiplicare l’altra (e viceversa) in modo che siano bilanciati (minimo comune multiplo) gli elettroni trasferiti (bilancio elettronico).
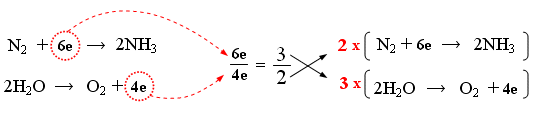
Infatti 2 molecole biatomiche di azoto acquistano complessivamente 12 elettroni, mentre i 6 atomi di ossigeno presenti nelle 6 molecole di acqua perdono complessivamente 12 elettroni.
Sommando membro a membro le due semireazioni si ottiene infine la reazione bilanciata
2N2 + 12e → 4NH3
6H2O → 3O2 + 12e
![]()
2N2 + 6H2O → 4NH3 + 3O2
I numeri di ossidazione frazionari sono numeri di ossidazione medi.
Nel caso dell’ottossido di triwolframio (W3O8), ad esempio, due atomi di Wolframio presentano nox +6, mentre il terzo presenta nox +4. Ciascun atomo di Wolframio ha dunque un numero di ossidazione medio pari +16/3.
1) Calcolo elettroni ceduti/acquistati.
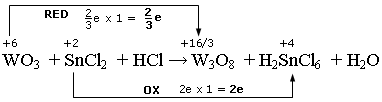
La variazione nel numero di ossidazione del Wolframio è Δnox = 6 - 16/3 = 2/3.
Ovviamente in questo caso la variazione nel numero di ossidazione non ha significato fisico (un atomo di Wolframio non può acquistare 2/3 di un elettrone), ma può essere comunque utilizzata per il bilanciamento.
2) Scrittura semireazioni e bilancio di massa
Scriviamo e bilanciamo le semireazioni
WO3 + 2e/3 → W3O8
(riduzione)
SnCl2 → H2SnCl6 + 2e
(ossidazione)
Lo Stagno è già bilanciato. Bilanciamo il Wolframio ed aggiorniamo il numero di elettroni acquistati da 3 atomi di Wolframio
3WO3 + 6e/3 → W3O8
che equivale a
3WO3 + 2e → W3O8
Il rapporto di scambio elettronico è 2/2 = 1. Le due semireazioni sono già bilanciate per quel che riguarda il numero di elettroni scambiati (la semireazione di ossidazione cede 2 elettroni, tanti quanti ne acquista la semireazione di riduzione).
Sommiamo membro a membro le due semireazioni
3WO3 + 2e → W3O8
SnCl2 → H2SnCl6 + 2e
![]()
3WO3 + SnCl2 → W3O8 + H2SnCl6
Aggiungiamo le altre specie chimiche che partecipavano alla reazione, ma che non avevano variato il loro numero di ossidazione.
3WO3 + SnCl2 + HCl → W3O8 + H2SnCl6 + H2O
e completiamo il bilanciamento
3WO3 + SnCl2 + 4HCl → W3O8 + H2SnCl6 + H2O
Si definiscono dismutazioni (o reazioni di ossidoriduzione interna) quei particolari processi redox in cui il trasferimento di elettroni avviene tra molecole di un medesimo composto. Un medesimo elemento è soggetto sia ad una riduzione che ad un’ossidazione.
Nell'esempio che segue, alcune molecole di ipoclorito si riducono a cloruro, altre si ossidano a clorato
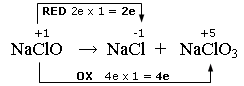
Scriviamo e bilanciamo le semireazioni
NaClO + 2e → NaCl
NaClO → NaClO3 + 4e
Il cloro è già bilanciato in entrambe le semireazioni.
Il rapporto di scambio elettronico è 2/4 = 1/2, pertanto moltiplichiamo rispettivamente per 2 e per 1 le due semireazioni per bilanciare gli elettroni scambiati
2 x ( NaClO + 2e → NaCl ) = 2NaClO + 4e → 2NaCl
1 x (NaClO → NaClO3 + 4e) = NaClO → NaClO3 + 4e
sommiamo membro a membro
2NaClO + 4e → 2NaCl
NaClO → NaClO3 + 4e
3NaClO → NaClO3 + 2NaCl
Ogni tre molecole di ipoclorito che dismutano, due si riducono a cloruro ed una si ossida a ipoclorito.
In reazioni redox complesse in cui più di due elementi variano il loro numero di ossidazione risulta più conveniente eseguire il bilancio elettronico aggiornando i coefficienti solo per i reagenti. Si sommano quindi le due semireazioni e si esegue successivamente il bilancio di massa aggiornando i coefficienti anche dei prodotti di reazione
Esempio 1)
Si consideri la seguente reazione
FeS2 + O2 → Fe2O3 + SO2
Qui abbiamo due elementi che si ossidano. Il Ferro che passa da ferroso (+2) a ferrico (+3) e lo Zolfo che passa da -1 a + 4.
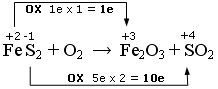
Nell’altra semireazione l’Ossigeno si riduce passando da 0 a -2
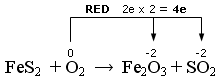
Scriviamo la semireazione di ossidazione
FeS2 → Fe2O3 + SO2 + 11e
ossidazione
Scriviamo la semireazione di riduzione
O2 + 4e → Fe2O3 + SO2
riduzione
Il rapporto di scambio elettronico è 11/4. Eseguiamo il bilancio elettronico moltiplicando per 4 i reagenti della semireazione di ossidazione e per 11 i reagenti della semireazione di riduzione.
4FeS2 → Fe2O3 + SO2 + 44e
11O2 + 44e → Fe2O3 + SO2
Combiniamo le due semireazioni
4FeS2 + 11O2→ Fe2O3 + SO2
ed ora completiamo il bilancio di massa aggiornando i coefficienti dei prodotti.
Bilanciamo il Ferro
4FeS2 + 11O2→ 2Fe2O3 + SO2
e poi lo Zolfo
4FeS2 + 11O2→ 2Fe2O3 + 8SO2
Esempio 2)
Si consideri la seguente reazione
Na2CO3 + C + N2 → CO + NaCN
In questo caso vi sono due elementi che si riducono. L’Azoto che passa da 0 a -3 ed il Carbonio del carbonato che passa da +4 a +2
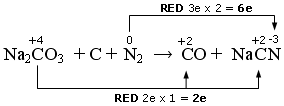
Nell’altra semireazione il Carbonio elementare si ossida passando da 0 a +2.
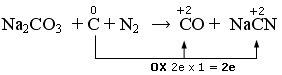
Scriviamo la semireazione di riduzione
Na2CO3 + N2 + 8e → NaCN
riduzione
Scriviamo la semireazione di ossidazione
C → CO + NaCN + 2e
osidazione
Il rapporto di scambio elettronico è 8/2 = 4/1. Eseguiamo il bilancio elettronico moltiplicando per 1 i reagenti della semireazione di riduzione e per 4 i reagenti della semireazione di riduzione
1Na2CO3 + N2 + 8e → NaCN
4C → CO + NaCN + 8e
Combiniamo le due semireazioni
Na2CO3 + N2 + 4C → CO + NaCN
ed ora completiamo il bilancio di massa aggiornando i coefficienti dei prodotti.
Bilanciamo il Sodio
Na2CO3 + N2 + 4C → CO + 2NaCN
ed infine l’Ossigeno
Na2CO3 + N2 + 4C → 3CO + 2NaCN
Spesso le reazioni redox vengono rappresentate in forma ionica netta, riportando solo gli ioni e le molecole indissociate nelle quali avviene un cambiamento del numero di ossidazione ed eventualmente, se necessario ioni H+, OH- e molecole di H2O a seconda che la reazione avvenga in ambiente acido, basico o neutro.
Quando una redox viene proposta in forma ionica è necessario specificare se essa decorre in ambiente acido, basico o neutro. Più correttamente, se la reazione decorre in ambiente acido dovrebbe comparire uno ione H+ sopra la freccia di reazione, mentre se decorre in ambiente basico dovrebbe comparire uno ione OH- sopra la freccia di reazione.
La strategia di bilanciamento prevede
Esempio 1 – redox in forma ionica in ambiente acido
I- + MnO4- ![]() I2 + Mn2+
I2 + Mn2+
1) si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell’elemento che reagisce. Nell’esempio il Manganese diminuisce il suo nox (riduzione) da +7 a +2, con una variazione di 5 elettroni, mentre lo Iodio passa da -1 a 0 (ossidazione) con una variazione di 1 elettrone
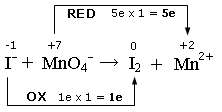
2) Si scrivono le semireazioni di ossidazione e di riduzione. Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti. Nell’esempio che segue dobbiamo bilanciare lo Iodio ed aggiornare a 2 il numero di elettroni persi durante la semireazione di ossidazione (1 elettrone per ciascun atomo di Iodio)
2I- → I2 + 2e
(ossidazione)
MnO4- + 5e → Mn2+
(riduzione)
3) Si esegue il bilancio di carica per ogni semireazione con ioni H+ (ambiente acido) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi. Si determina quindi il rapporto di scambio elettronico, (rapporto tra elettroni persi ed elettroni acquistati),
La semireazione di ossidazione è già a posto in quanto presenta due cariche negative tra i reagenti e due cariche negative tra i prodotti (i due elettroni)
1) si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell’elemento che reagisce. In questo caso si tratta di una redox in cui il Manganese (nox = +7) si riduce, diminuendo il suo numero di ossidazione a +4 (Δnox = 3e) e l’Azoto (-3) si ossida, aumentando il suo numero di ossidazione a +5 (Δnox = 8e).
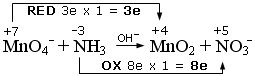
2) si scrivono le semireazioni di ossidazione e di riduzione Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti. Nell’esempio che segue sia l’Azoto che il Manganese risultano già bilanciati.
NH3 → NO3- + 8e
(ossidazione)
MnO4- + 3e → MnO2
(riduzione)
3) Si esegue il bilancio di carica per ogni semireazione con ioni OH- (ambiente basico) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi. Si determina quindi il rapporto di scambio elettronico, (rapporto tra elettroni persi ed elettroni acquistati),
Aggiungiamo 4 ioni OH- tra i prodotti per bilanciare la carica e 2 molecole d’acqua tra i reagenti per ribilanciare la massa
MnO4- + 2H2O + 3e → MnO2 + 4OH-
Il rapporto di scambio elettronico tra le due semireazioni è 8/3 (per ogni 8 elettroni persi dalla semireazione di ossidazione vi sono 3 elettroni acquistati dalla semireazione di riduzione)
4) Usiamo il rapporto di scambio elettronico per il bilancio degli elettroni. Si usa il numero di elettroni trovato in una semireazione per moltiplicare l’altra (e viceversa) in modo che siano bilanciati gli elettroni trasferiti. Si sommano quindi le due semireazioni
(9OH- + NH3 → NO3- + 6H2O + 8e) x 3 = 27OH- + 3NH3 → 3NO3- + 18H2O + 24e
(MnO4- + 2H2O + 3e → MnO2 + 4OH-) x 8 = 8MnO4- + 16H2O + 24e → 8MnO2 + 32OH-
= 8MnO4- + 3NH3 → 8MnO2 + 3NO3- + 5OH- + 2H2O
5) Nel caso tutti i coefficienti siano divisibili per un medesimo numero, si esegue la semplificazione (in questo caso non è necessario).
Esempio 3 – Dismutazione in forma ionica in ambiente basico
P4 ![]() H2PO2- + PH3
H2PO2- + PH3
1) si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell’elemento che reagisce. In questo caso si tratta di una dismutazione in cui il Fosforo elementare (nox = 0) si ossida, aumentando il suo numero di ossidazione a +1 (Δnox = 1e) e si riduce a -3, diminuendo il suo numero di ossidazione a -3 (Δnox = 3e).
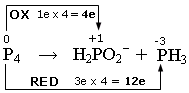
2) si scrivono le semireazioni di ossidazione e di riduzione Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti.
P4 → H2PO2- + 4e
(ossidazione)
P4 + 12e → PH3
(riduzione)
bilanciamo gli atomi di Fosforo
P4 → 4H2PO2- + 4e
P4 + 12e → 4PH3
3) Si esegue il bilancio di carica per ogni semireazione con ioni OH- (ambiente basico) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi. Si determina quindi il rapporto di scambio elettronico, (rapporto tra elettroni persi ed elettroni acquistati),
La semireazione di ossidazione presenta 8 cariche negative tra i prodotti e nessuna carica tra i reagenti
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve