I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
GLI STATI FISICI DELLA MATERIA
Il mondo fisico che ci circonda è costituito da materiali diversi.
Gli oggetti hanno una massa e occupano un determinato spazio ossia hanno un volume. I materiali possono esistere in tre forme diverse o meglio in tre stati fisici diversi tali stati fisici vengono anche denominati stati di aggregazione della materia.
LA MATERIA
La materia: tutto ciò che ha massa e dimensioni (occupa uno spazio) ed è soggetto alla forza di gravità.
I materiali si presentano allo stato solido, allo stato liquido e allo stato aeriforme (sotto forma di gas o di vapore).
Stato solido: le particelle costituenti la materia sono strettamente unite una all'altra in modo più o meno geometricamente ordinato. Dette particelle oscillano intorno al proprio punto di applicazione; da questo non possono, però, muoversi in quanto sono circondate da altre particelle.
Stato liquido: le particelle hanno una energia cinetica (energia di movimento) maggiore di quella dello stato solido, possono muoversi disordinatamente ed urtarsi tra loro. Minori rispetto allo stato solido sono le forze coesive, tanto che sulla superficie un certo numero di particelle, può sottrarsi del tutto all'attrazione delle altre, passando allo stato gassoso. I liquidi, infatti, esistono sempre in presenza del loro gas.
Stato aeriforme: le particelle si muovono in maniera caotica occupando tutto lo spazio a disposizione e le forze di coesione sono del tutto trascurabili. Gli aeriformi possono essere sia gas e sia vapori
GAS: stato della materia aeriforme alla temperatura e pressione ambientale (T = 25°C e Pressione = 1 atm) esempio ossigeno, metano, anidride carbonica, elio ecc..
VAPORE: stato della materia aeriforme alla temperatura e pressione diversa da quella ambientale (T = 25°C e Pressione = 1 atm) esempio vapor d’acqua, vapori di alcool etilico ecc..
Esiste un quarto stato di aggregazione, il plasma, che si ha portando un gas a temperature superiori a 5000 °C. In tale situazione uno o più elettroni esterni si staccano formando uno ione; il plasma è, quindi, formato da cationi e da elettroni in equilibrio tra loro. Le stelle sono, ad esempio, allo stato di plasma così come lo è la materia presente nei " tubi al neon ".
Il moto delle particelle diviene sempre più rapido, al crescere della temperatura, che tende a separare le molecole costituenti la materia. Fra le particelle ci sono forze di attrazione, di natura elettrostatica (fra cariche positive e negative), che si oppongono all’azione disgregatrice della temperatura. Tali forze di coesione sono particolarmente attive nei solidi, meno efficaci nei liquidi e del tutto trascurabili nei gas. Quando la temperatura è sufficientemente bassa, le forze di coesione predominano e quindi è possibile portare i gas, prima allo stato liquido e poi allo stato solido. Secondo il modello particellare, nei corpi:
Il moto di atomi e molecole è tanto più intenso quanto più alta è la temperatura.
Tabella Proprietà caratteristiche dei tre stati d i aggregazione dei materiali
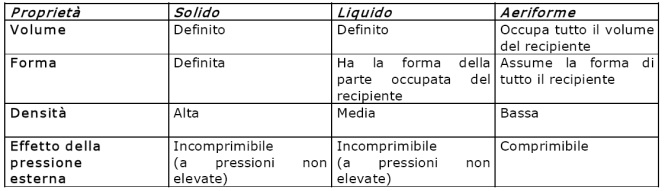
I corpi solidi, come le pietre, il vetro, il ghiaccio, hanno una definita massa, un volume e una forma propria.
I corpi liquidi, come l’acqua, il latte, il mercurio, hanno una massa e un volume definiti, come i solidi, ma assumono la forma della parte di recipiente che li contiene.
Infine ci sono gli aeriformi. I gas e i vapori hanno una massa propria, ma si espandono, sino ad occupare tutto il volume e ad assumere la forma del recipiente che li contiene. C’è un’altra differenza: i gas si possono comprimere, mentre i solidi e i liquidi sono, in larga misura, incomprimibili.
I PASSAGGI DI STATO
Le sostanze e i materiali possono passare, per effetto delle variazioni di temperatura o di pressione, da uno stato fisico ad un altro. Nella figura sono riportati tutti i possibili passaggi d i stato e le loro denominazioni.
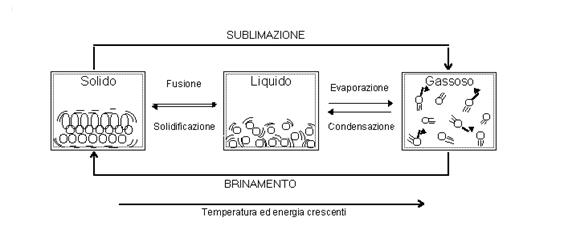
Fornendo calore a un cubetto di ghiaccio (solido), alla temperatura di 0 °C, esso si trasforma in acqua (liquido). Tale passaggio da solido a liquido è chiamato fusione.
Riscaldando l’acqua si ottiene vapore d’acqua. Tale passaggio di stato dalla fase liquida a quella di vapore è chiamato evaporazione.
Alcune sostanze solide, per riscaldamento, si trasformano direttamente in vapore, senza passare per lo stato liquido. Questo processo è denominato sublimazione. Fra le sostanze che sublimano c’è la naftalina e gli altri prodotti, usati come antitarme. Anche la neve sublima. Alle basse temperature dell'alta montagna, la quantità di neve che diventa vapore, per sublimazione, è molto maggiore di quella che scorre via, passando allo stato liquido.
Comportamento opposto si ottiene, sottraendo energia termica (calore). Avvengono i passaggi di stato in senso inverso. Gli aeriformi possono trasformarsi direttamente in solidi e il fenomeno viene denominato brinamento. I gas possono pure trasformarsi in liquidi e il processo è chiamato liquefazione.
Mentre i vapori diventano liquidi attraverso un fenomeno denominato condensazione.
Infine, i liquidi, per raffreddamento, solidificano .
Bisogna però precisare che i gas non passano allo stato liquido per semplice abbassamento della temperatura. Ad essi bisogna applicare anche una consistente pressione, se si vuol raggiungere la liquefazione. Per esempio, l’aria deve essere raffreddata alla sua temperatura critica (140,8°C) e deve essere sottoposta a una pressione di circa 37,2 atmosfere (pressione critica), prima
di diventare liquida.
LA CURVA DI RISCALDAMENTO DI UNA SOSTANZA PURA
Un eccellente metodo per verificare il grado di purezza di un solido consiste nel determinare la sua temperatura di fusione, denominata anche punto di fusione della sostanza.
Poni nel freezer a 18°C un bicchiere d’acqua distillata e un termometro. Il blocco di ghiaccio col termometro, estratto dal freezer, segnerà la temperatura di 18°C.
Lascia riscaldare, a temperatura ambiente, il bicchiere contenente ghiaccio e termometro e annota le temperature.
L’ambiente esterno fornisce il calore, necessario alla prima trasformazione fisica. Riportando su un grafico le temperature, in funzione del tempo, ottieni la cosiddetta curva d i riscaldamento ,rappresentata sotto.
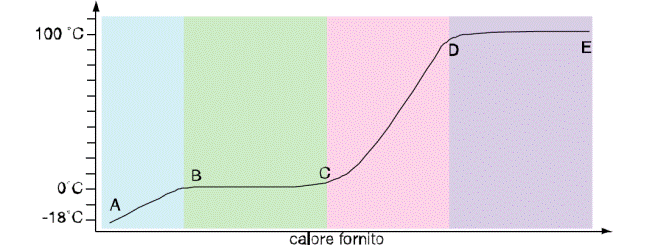
La temperatura cresce prima in maniera regolare, passando da 18°C a 0 °C (area celeste). Poi, quando il ghiaccio inizia a fondere, si ha un gradino sulla curva. Segno evidente che il calore, ceduto dall’ambiente, non fa aumentare la temperatura del miscuglio acqua-ghiaccio.
La temperatura, a cu i coesistono acqua distillata e ghiaccio, è denominata temperatura di fusione.
La temperatura di fusione è una proprietà intensiva (cioè non dipende dalla quantità) dell’acqua distillata e di tutte le sostanze pure.
Perché durante la fusione la temperatura non sale, pur continuando a fornire calore al sistema eterogeneo acqua-ghiaccio?
Perché il calore assorbito serve a vincere le forze di coesione del solido e lo trasforma in liquido cioè il sistema assorbe calore per rompere le forze di coesione senza far aumentare la temperatura.
Terminata la fusione di tutto il ghiaccio, la temperatura ricomincia a salire. La lunghezza del gradino, chiamata sosta termica, dipende dalla quantità di ghiaccio, che deve fondere. Maggiore è la quantità di ghiaccio, più lungo sarà il segmento BC (area verde).
Continuando a riscaldare, la temperatura sale con regolarità, sino a 100 °C (area rosa). Nell’intervallo di temperatura 0 °C ÷ 100 °C l’acqua evapora. Il vapore esercita una pressione, detta anche tensione di vapore, che è minore della pressione esterna. A 100 °C e alla pressione di 1 atmosfera inizia la produzione tumultuosa del vapore e diremo che l’acqua bolle (area viola).
La lunghezza del tratto BC (sosta termica) dipende dalla quantità d’acqua. Sino a quando l’ultima goccia d’acqua non si sarà trasformata in vapore, la temperatura non ricomincerà a salire, pur continuando a fornire calore. Se la temperatura non varia, qual è il destino del calore ceduto al corpo? Il calore viene utilizzato per vincere le forze di coesione del liquido. Nel vapore tali forze risultano molto meno intense.
Scomparso il liquido, il riscaldamento farà aumentare la temperatura del vapore in maniera regolare e la curva ricomincerà a salire. Analoghe curve, come quella disegnata per l’acqua, si hanno con tutte le altre sostanze pure. Cambiano soltanto le temperature di fusione e di ebollizione, che saranno tipiche delle diverse sostanze pure (tab. 2).

E se sottoponi a riscaldamento una soluzione acquosa di sale, che è un sistema omogeneo come l’acqua distillata, avrai una curva uguale a quella descritta sopra? No. La curva sarà diversa.
Mancheranno le soste termiche così nette della fusione e dell’ebollizione. Cioè, durante la fusione la temperatura aumenterà gradualmente, mano a mano che scompare il solido e si forma il liquido. Altrettanto accadrà per l’ebollizione. In genere, i passaggi di stato delle soluzioni e dei miscugli avvengono a temperature che non rimangono costanti, durante il passaggio di stato.
Può l’acqua bollire a una temperatura più bassa o più alta di quella a pressione atmosferica? La risposta è sì. Se si abbassa la pressione esterna, l’acqua bolle sotto i cento gradi; se, invece, si aumenta la pressione esterna, l’acqua bolle a una temperatura superiore ai cento gradi. In alta montagna, dove la pressione è inferiore a 1 atmosfera, l’acqua bolle a circa 80 °C. Per questo motivo, la pasta cotta in montagna non raggiunge livelli elevati di qualità.
La pentola a pressione consente di rendere più veloce la cottura dei cibi, innalzando la temperatura di ebollizione del miscuglio a circa 110 °C. L’innalzamento è reso possibile
dall’aumento di pressione del vapore, che preme sul liquido e ostacola la ‘’normale’’ ebollizione del miscuglio a circa cento gradi.
Qual è la differenza fra evaporazione ed ebollizione ?
Nell’evaporazione, il vapore si forma solo nello strato superficiale del liquido.
Riguarda solo gli strati superficiali del liquido. Le particelle di un liquido sono tenute assieme da diversi legami (forze di coesione). Tali particelle non hanno tutte la stessa energia cinetica, ossia energia di movimento. Tra le particelle in prossimità del liquido esistono particelle dotate di energia cinetica sufficiente per vincere le forze di attrazione fra le particelle e riescono a sfuggire dal liquido e a passare allo stato di vapore.
Inizialmente sono sempre di più le particelle che passano allo stato di vapore e che occupano lo strato sovrastante al liquido, contemporaneamente però le particelle che si trovano allo stato di vapore possono urtare la superficie del liquido e ritornare allo stato liquido. Nella fase iniziale il numero di particelle che nell’unità di tempo passano allo stato di valore è maggiore al n. di partic. che dallo stato di vapore ritorno allo stato liquido. Nel tempo, se il recipiente è aperto, la velocità delle partic. a evaporare sarà sempre maggiore alla velocità delle part. a ritornare liquide. In breve il liquido sarà completamente evaporato, infatti buona parte delle particelle che evaporano sfuggono completamente dal recipiente e si disperdono nell’aria.
Prima o poi tutto il liquido evaporerà. Nel tempo, se il recipiente è chiuso il numero di particelle che evapora sarà uguale al n. delle particelle che condensano: per ogni molecola che evapora ci sarà una molecola che condensa e si parla di equilibrio dinamico. La vaporizzazione è un processo spontaneo che colpisce tutti i liquidi che evaporano a qualsiasi temperatura, non esiste dunque una temperatura precisa di vaporizzazione. Essa è accelerata dall’aumento della temperatura: l’aumento della temperatura causa un maggior movimento delle molecole. La evaporazione è favorita dall’ampiezza della superficie di contatto con l’ambiente esterno.
Anche la ventilazione favorisce l’ evaporazione perché sposta le molecole già evaporate che così non ristagnano sulla superficie di evaporazione e non urtano le molecole del liquido così non tornano allo stato liquido. L’aria al di sopra di un liquido rallenta l’evaporazione, in assenza di aria l’evap. avviene più velocemente. Le particelle allo stato di vapore esercitano una pressione sulla superficie del liquido sottostante: si parla di tensione o pressione di vapore saturo, ed è la pressione esercitata in condizioni di equilibrio dalle particelle allo stato di vapore sul liquido.
Nell’ebollizione, le bolle di vapore si formano all’interno e in fondo al liquido e non solo in superficie.
La temperatura, a cu i la pressione del vapore eguaglia la pressione esterna, è detta temperatura di ebollizione oppure punto d i ebollizione del liquido puro esaminato.
Il punto di ebollizione è un’altra proprietà intensiva dell’acqua e di tutte le altre sostanze pure, allo stato liquido. La temperatura di ebollizione dell’acqua è sempre la stessa e non dipende dalla quantità d’acqua (una goccia, un litro, o più). Ciascuna sostanza pura si distingue da un’altra sostanza pura, per il diverso valore della temperatura di fusione e della temperatura di ebollizione.
I CALORI LATENTI DI FUSIONE E DI VAPORIZZAZIONE
L’energia termica, scambiata durante i passaggi di stato, di fusione e di ebollizione, è chiamato calore latente, perché non comporta aumenti o diminuzioni di temperatura. È un calore che non si vede (dal latino latere, cioè nascondere), ma serve a indebolire le forze di coesione di solidi e liquidi. Il calore da fornire a 1 grammo di ghiaccio, per farlo fondere, è più di sei volte inferiore al calore richiesto dalla vaporizzazione di 1 grammo d’acqua. Tale differenza dipende dal fatto che è più difficile vincere le forze di coesione di un liquido, che diventa vapore, che ridurre le forze di coesione di un solido.
PASSAGGI DI STATO E PRESSIONE
La temperatura di fusione e la temperatura di ebollizione di una sostanza sono condizionate dall’entità della pressione esterna. Prima di spiegare questo aspetto, si deve chiarire un punto importante: il passaggio dallo stato solido allo stato liquido di un corpo comporta sempre un aumento di volume, ad eccezione dell’acqua e di pochi altri materiali, per i quali il volume diminuisce con la fusione.
La riduzione della pressione esterna rende più facile l’ebollizione delle sostanze.
La fusione e la solidificazione sono poco influenzate dalle variazioni esterne della pressione.
Perché? La pressione si può immaginare come qualcosa che prema sui solidi e sui liquidi. Quando il liquido si trasforma in vapore, deve aumentare di molto il proprio volume (di circa mille volte).
Una pressione esterna elevata contrasta questa espansione e l'ebollizione si avrà a temperatura più alta. Invece, la riduzione di pressione favorisce l’espansione e fa abbassare il punto di ebollizione .
Nel passaggio da solido a liquido, l'aumento di volume è molto piccolo e quindi non viene ostacolato dalla pressione elevata. Per l'acqua, una delle poche eccezioni, la pressione elevata favorisce leggermente la fusione, poiché nella trasformazione il suo volume si riduce. Pertanto l'acqua, sottoposta a pressione elevata, solidifica a temperatura leggermente inferiore a 0 °C. La pressione necessaria per far solidificare il ghiaccio a 1 °C è di 133 atmosfere. Un pattinatore di 70 kg, che prema sul ghiaccio con una superficie della lamina di appena 0,5 cm 2 raggiunge questa pressione.
SISTEMI OMOGENEI E SISTEMI ETEROGENEI
I materiali possono essere classificati anche come omogenei e come eterogenei. Esamina l’acqua contenuta in un bicchiere. Questa porzione di materia, cioè questo sistema, è un esempio di materia omogenea. L’omogeneità deriva dal fatto che il sistema acqua è visibilmente uniforme.
Ogni piccola porzione, dell’acqua contenuta nel bicchiere, avrà lo stesso colore e la stessa densità la stessa temperatura di ebollizione di qualsiasi altra porzione. Queste proprietà sono chiamate proprietà intensive . Siccome tutte le regioni, dentro l’acqua, hanno le stesse proprietà intensive, e non sono distinguibili l’una dall’altra, dirai che il corpo è omogeneo o meglio il sistema è omogeneo.
Supponi di versare nel bicchiere anche alcuni cucchiai d’olio di oliva. Siccome l’olio è un liquido che non si scioglie in acqua, ti aspetterai di vedere due strati liquidi: l’acqua sotto e sopra l’olio
Tale visibile non uniforme porzione di materia è chiamata sistema eterogeneo . Quante serie di proprietà intensive si possono scrivere per i due liquidi nel bicchiere ? Avrai la serie delle proprietà intensive dell’acqua (colore, densità, ecc...) e quella dell’olio (colore, densità, ecc..). Il liquido nel bicchiere sarà costituito da due distinte fasi liquide, e ciascuna avrà la propria serie di proprietà
intensive. Alla luce di quanto descritto, come definisci la fase ?
Si dice fase una porzione di materia, fisicamente distinguibile, che ha uniformi proprietà intensive ( colore, densità, temperatura di ebollizione ecc ...) .
Le fasi sono porzioni di materiali omogenei, cioè sono sistemi omogenei, fisicamente distinguibili perché delimitati da un contorno esterno, ben definito e visibile.
Riassumendo: un sistema può essere omogeneo oppure eterogeneo, a seconda che sia costituito da una sola fase oppure da due o più fasi.
SOSTANZE PURE E MISCUGLI
I materiali possono anche essere suddivisi in due distinte categorie: le sostanze pure e i miscugli.
Sia le sostanze pure che i miscugli possono essere omogenei ed eterogenei.
La sostanza pura
Secondo il linguaggio comune l’acqua potabile e l’acqua minerale sono pure. Altrettanto puri sono il latte e l’aria, che respiriamo in alta montagna. Quindi la parola purezza, nel linguaggio comune è sinonimo di "non contaminato". Un significato più preciso assume in chimica l’aggettivo puro.
Quando il chimico afferma che un corpo è puro vuol dire soltanto che l’oggetto indicato è formato da una sola sostanza. Quindi, passando alla definizione:
un sistema è puro solo se formato da una singola sostanza, la quale possiede proprietà caratteristiche e ha un a composizione costante.
L’acqua distillata è pura perché è acqua al 100% . Mentre non è pura l’acqua di rubinetto, perché in essa ci sono disciolte altre sostanze. Difatti, se lasci evaporare l’acqua potabile, troverai nel contenitore un residuo bianco. Anche l’aria di montagna e il latte non sono puri, da un punto di vista chimico, bensì sono costituiti da sostanze diverse.
Ma anche il concetto di purezza chimica si presta a qualche riflessione critica. L’idea di sostanza pura è un’astrazione, giacché tutte le sostanze reali sono più o meno impure. E allora come si denomina una porzione di materia che non è completamente pura ?
Il termine materiale sembra il più adatto a questo scopo. Se non si è sicuri della purezza della materia che compone un oggetto, un corpo o un sistema, è preferibile usare la parola materiale per indicarlo e non la parola sostanza. I materiali possono essere costituiti da sostanze pure oppure da miscugli di sostanze diverse.
C’è pure da dire che le impurezze non sono sempre indesiderabili e dannose. Per esempio, il silicio, un materiale semiconduttore usato nei circuiti elettronici, è considerato una delle sostanze più pure. Il silicio è puro per il 99,9999%. Le sue straordinarie proprietà, utilizzate in campo elettronico, sono dovute proprio alle impurezze che il silicio contiene.
I miscugli omogenei e i miscugli eterogenei
I sistemi che esaminerai possono essere costituiti da una sola sostanza oppure da più sostanze.
Un sistema formato da una sola sostanza pura può essere omogeneo oppure fisicamente eterogeneo. Per esempio, l’acqua distillata purissima, allo stato liquido, costituisce un esempio di sistema omogeneo. A 0 °C l’acqua distillata pura si trova in parte in fase solida (ghiaccio) e in parte in fase liquida, pertanto il sistema è fisicamente eterogeneo. Anche se costituito da una sola sostanza pura, si tratta di un sistema formato da due fasi e quindi sicuramente eterogeneo. I 15 milioni di sostanze pure, sino ad oggi conosciute, si comportano alla stessa maniera dell’acqua, quando si trovano alle rispettive temperature di fusione.
Più semplice risulta definire i sistemi costituiti da due o più sostanze. A tali sistemi diamo il nome di miscugli o di miscele . Pure i miscugli possono essere omogenei ed eterogenei.
Se prendi del sale e lo sciogli completamente in acqua, avrai un miscuglio omogeneo. I grani di sale non saranno più visibili, neanche al microscopio, e otterrai una singola fase. Tutte le zone del miscuglio avranno le stesse proprietà intensive (colore, densità, ecc..). Anche acqua e alcol formano un miscuglio omogeneo. A tali miscugli omogenei darai il nome di soluzione alla quale
compete la seguente definizione.
Un miscuglio omogeneo d i due o più sostanze è chiamato soluzione. Il materiale più abbondante del miscuglio è il solventementre i materiali meno abbondanti si chiamano soluti.
Ci sono anche i miscugli eterogenei di due o più sostanze. Nei miscugli eterogenei le differenti parti (fasi) sono visibili al microscopio o addirittura a occhio nudo, come i minerali costituenti il granito. Come si definisce un miscuglio eterogeneo ?
Un miscuglio eterogeneo è costituito da componenti chimicamente definiti e da fasi fisicamente distinguibili.
La maggior parte dei materiali, che conosci, non sono sostanze singole, ma miscugli, più o meno complessi, di sostanze diverse. L’aria che respiri è un miscuglio omogeneo di azoto, di ossigeno e di altri gas, in percentuale minore.
Il latte è un classico esempio di miscuglio eterogeneo. Apparentemente il suo aspetto è uniforme; l’osservazione al microscopio, invece, rivela l’esistenza di minuscole goccioline di grasso, immerse in un liquido trasparente. Il fatto che il latte sia opaco dimostra la sua eterogeneità.
Le soluzioni non sono soltanto liquide, come acqua e sale oppure acqua e zucchero. Si conoscono soluzioni gassose, come l’aria che respiri. Ci sono pure le soluzioni solide, come l’acciaio, il bronzo e le altre leghe metalliche.
Nebbia, fumo, schiuma ed emulsione sono miscugli eterogenei
Comincia a definire i miscugli eterogenei gas liquido.
La schiuma è un tipico miscuglio costituito dalla dispersione di un gas in un liquido. Una soluzione saponosa si trasforma in schiuma, insufflando aria con una cannuccia. Il bianco d’uovo sbattuto incorpora un certa quantità d’aria e
si ottiene una schiuma.
La nebbia è formata da minuscole goccioline d’acqua disperse e sospese nell’aria. Anche le nubi sono un miscuglio eterogeneo acquaaria.
Infine, il fumo è un miscuglio eterogeneo di un solido in un gas. Il fumo dei camini è costituito, in buona parte, da particelle finissime di carbone disperse in aria. L’emulsione è un miscuglio eterogeneo tra due o più liquidi immiscibili . L’emulsione si ottiene agitando energicamente i liquidi immiscibili, in maniera da ottenere la formazione di minuscole goccioline, difficilmente separabili. La maionese è un esempio di emulsione, ottenuta agitando olio e tuorlo d’uovo.
Il sol è un miscuglio eterogeneo di un liquido disperso in un gas
I COLLOIDI SON O SPECIALI MISCUGLI
La distinzione fra miscugli omogenei e miscugli eterogenei non è netta. C’è una classe di materiali che si colloca a mezza strada fra i miscugli omogenei e quelli eterogenei. A questa classe appartengono i colloidi, che sono considerati ‘’pseudosoluzioni’’, in quanto, a un esame superficiale, appaiono come miscugli omogenei. In realtà, i colloidi sono sospensioni di grandi particelle (20.000 ÷ 100.000 nanometri di diametro) in un solvente. Differiscono dalle soluzioni,
perché le particelle sospese sono abbastanza grandi da diffondere la luce. Se la fase disperdente, liquida o gassosa, prevale su quella solida (fase dispersa), si ha un sol. Se, invece, prevale la fase solida si ha un gel. Sono colloidi alcuni componenti del citoplasma delle cellule, dell’albume dell’uovo, della gelatina, del budino, delle caramelle gommose, maionese, ecc. Quando i colloidi solidificano si ottiene una massa compatta.
Fonte: http://www.liceocottini.it/files/DOCUMENTI/materiale%20didattico/chimica/2_Gli%20stati%20fisici%20della%20materia.doc
Sito web da visitare: http://www.liceocottini.it/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve