I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Nello studio dei gas perfetti è fondamentale il concetto di velocità quadratica media ( root-mean-square speed, vrms ) che è la velocità che si ottiene facendo la radice quadrata del valore medio dei quadrati delle singole velocità.
Es: Cinque molecole di un gas prese a caso hanno le seguenti velocità: 500, 600, 700, 800, 900 m/s. Trova la loro velocità media e la velocità quadratica media.
![]()
![]()
Possiamo notare che la velocità media e la velocità quadratica media non hanno lo stesso valore, in particolare la vrms è più grande della velocità media perché in essa hanno un peso maggiore le velocità più alte.
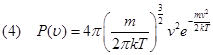
La velocità (quadratica) media di cui si è fin qui parlato non rappresenta la velocità effettiva di ciascuna molecola. Di fatto, alcune molecole sono veloci, altre sono lente e altre ancora hanno velocità intermedie. In sostanza le velocità si distribuiscono attorno alla velocità media secondo una certa regola detta "legge delle distribuzione delle velocità di Maxwell-Boltzmann" così formulata:
Dove: v è la velocità molecolare, T è la temperatura del gas, m è la massa di una molecola. Questa equazione è rappresentata nella figura seguente.
La quantità P(v) è una funzione detta di distribuzione definita nel seguente modo:
Il prodotto P(v)Dv(che è una quantità adimensionale) è la frazione di molecole le cui velocità sono comprese tra v e v+Dv.
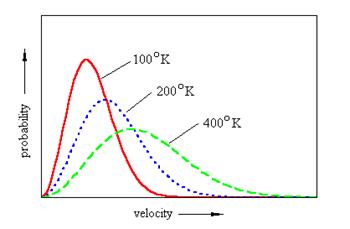
Come mostra la figura 1 questa frazione è uguale all'area di una striscia la cui altezza è P(v) e la cui larghezza è Dv. L'area totale sotto la curva di distribuzione corrisponde alla frazione di molecole le cui velocità vanno da zero a infinito; poiché tutte le molecole cadono in questa categoria il valore di quest'area totale è uno. La velocità più probabile vp è la velocità alla quale P(v) è massima. La velocità quadratica media è maggiore della velocità più probabile. Tra queste due velocità si inserisce la "vera" velocità media calcolata come media aritmetica delle velocità molecolari.
![]()
Quindi, il maggior numero di molecole possiede valori delle velocità intorno al massimo della curva, invece poche sono le molecole con velocità molto basse o molto alte. Queste molecole hanno un'importanza fondamentale nelle reazioni chimiche.
Reazioni chimiche: Molte reazioni chimiche sono fortemente dipendenti dalla temperatura e la ragione di ciò è contenuta nella (4). Le molecole dei reagenti devono urtarsi violentemente per poter provocare la rottura dei legami preesistenti altrimenti tali molecole semplicemente rimbalzeranno. L'energia cinetica minima che esse devono possedere per reagire è detta energia di attivazione. La velocità associata a tale energia si chiama velocità di attivazione. La figura 2 mostra che il numero di molecole aventi velocità superiore alla velocità di attivazione aumenta notevolmente con la temperatura. E' così spiegato il forte effetto della temperatura sulla velocità di reazione
Sole:Il Sole non brucia combustibili chimici ma la sua energia è generata dal processo di fusione di due nuclei di idrogeno che si trasformano in nuclei di elio liberando in ogni evento circa 3x10-12J. Tuttavia i protoni si respingono l'un l'altro essendo due cariche elettriche dello stesso segno (positive); pertanto i protoni che hanno una velocità prossima a quella media della curva Maxwelliana non hanno abbastanza energia cinetica per avvicinarsi ed innescare questa reazione. Ma i protoni molto veloci con velocità nella parte destra della curva di distribuzione possono farlo ed è così che il Sole splende.
Al crescere della temperatura, la curva di distribuzione si sposta verso destra perché aumentala percentuale di particelle con velocità maggiori, nello stesso tempo si appiattisce in quanto l'area sottesa, che corrisponde al numero totale di particelle, deve rimanere costante.
Pioggia: Le molecole d'acqua in uno stagno hanno una distribuzione delle velocità simile a quella descritta dalla legge di Maxwell per i gas. La maggior parte di molecole non hanno abbastanza velocità, e quindi energia cinetica, per sfuggire dall'acqua. Tuttavia un numero piccolo di molecole molto veloci con velocità nell'estrema destra della curva di distribuzione riesce a sfuggire. Sono queste molecole d'acqua che evaporando rendono possibile le nuvole e la pioggia.
Nota. La (4) può essere scritta in funzione dell'energia cinetica:
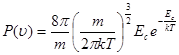
Da notare anche la forza somiglianza della (4) con la "funzione di distribuzione" della probabilità radiale dell'elettrone nello stato 1s dell'idrogeno è:
![]()
La probabilità di trovare l'elettrone ad una distanza compresa tra r e r+Dr è P(r)Dr.
Fonte: http://www.fisicaweb.org/doc/gas/Maxwell-Boltzmann.doc
Sito web da visitare: http://www.fisicaweb.org/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve