I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
L'ORBITALE ATOMICO
Come è fatto un atomo? Agli inizi del 1900, dopo la scoperta del protone e dell’elettrone, il modello atomico più plausibile fu quello proposto da Bohr il quale si basa sui seguenti tre principi:
1) Le orbite sono quantizzate: cioè l'elettrone può ruotare attorno al nucleo solo su orbite prestabilite, dette appunto "quantizzate"; non è consentito all'elettrone occupare spazi intermedi tra un'orbita e l'altra. Il raggio di queste orbite quantiche è:
(1) R = n2rB
in cui la quantità rB , chiamata raggio di Bohr, vale rB = 0.5310-10 m.
Pertanto l'elettrone può ruotare attorno al nucleo soltanto su orbite i cui raggi siano multipli interi del raggio di Bohr, in particolare il raggio della prima orbita è pari a rB, il raggio della seconda orbita è 4 volte il raggio della prima cioè 4x0.53x10-10=2.12x10-10 m, il raggio della terza è 9 volte il raggio della prima..….
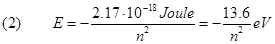
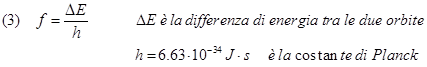
Tuttavia tale teoria non riusciva a spiegare in modo soddisfacente le proprietà degli atomi a più elettroni e per tale motivo nel 1930 venne completata con la seguente regola fondamentale nota come Principio d'indeterminazione di Heinsenbreg:
" E' impossibile conoscere con precisione, in un dato momento, la posizione e la velocità di un elettrone, in altri termini, non è possibile prevedere la traiettoria di un elettrone all'interno dell'atomo"
Ecco la prima grande differenza tra la nuova teoria e quella di Bohr che assegnava traiettorie circolari agli elettroni. Secondo la nuova teoria l'elettrone si muove all'interno dell'atomo in tutte le direzioni senza seguire traiettorie precise. Di conseguenza" Non è mai possibile dire dove si trova esattamente l'elettrone (e in generale tutte le particelle elementari); si può soltanto calcolarne la probabilità che ha, in un dato istante, di trovarsi in un certo punto.
Ogni elettrone tuttavia, non tende a muoversi per tutto il volume dell'atomo ma occupa di preferenza una certa zona intorno al nucleo la cui forma dipende principalmente dal livello energetico dell'elettrone. Di conseguenza:
def: Chiamiamo orbitale atomico di un elettrone la regione di spazio intorno al nucleo in cui la probabilità di trovare l'elettrone è molto alta.
Es: Il luogo in cui è più facile incontrare …………, in una mattina di un giorno feriale di marzo è la scuola. Allora l'orbitale atomico di Beretta è l'edificio scolastico. Non siamo però sicuri di incontrarlo perché può subentrare un fatto eccezionale, quale una malattia o un impegno familiare. Vi è un'alta probabilità di trovarlo al Greppi, ma non vi è la certezza!
I NUMERI QUANTICI
La meccanica quantistica descrive l'orbitale atomico mediante alcuni parametri rappresentati da quattro numeri:
numero massimo di elettroni = 2n2
Pertanto, nel livello energetico corrispondente a n=1 si hanno al massimo 2 elettroni, al livello n=2 gli elettroni possono essere 8 e così via
l |
forma orbitale |
0 |
s |
1 |
p |
2 |
d |
3 |
f |
Il numero dei sottolivelli cresce man mano che aumenta il numero quantico principale. Precisamente tale numero è dato dalla relazione:
l = 0,1,2…n-1 valore max n-1
n |
numero sottoliv. |
1 |
0 s |
2 |
0,1 s,p |
3 |
0,1,2 s,p,d |
4 |
0,1,2,3 s,p,d,f |
Il livello n =1 ha soltanto il sottolivello l = 0 al quale corrisponde un orbitale di forma sferica denominato di tipo s; poiché il numero quantico principale è 1 l'orbitale viene denominato 1s
Il livello n = 2 ha l = 0 e l =1; quindi, esso ha un orbitale s, denominato 2s, e altri orbitali p, denominati 2p. L'orbitale 2s è anch'esso sferico, ma il suo raggio è maggiore di quello dell'orbitale 1s; di conseguenza, la distanza più probabile dell'elettrone dal nucleo è maggiore nell'orbitale 2s. Nel terzo livello si avranno 3 sottolivelli, 3s, 3p, 3d. Nel quarto livello si avranno 4 sottolivelli: 4s, 4p, 4d, 4f. L’energia degli orbitali cresce con l’aumentare del valore di l: Es<Ep<Ed<Ef.
Ogni tipo di sottolivello può contenere un numero massimo di elettroni e precisamente:
sottolivello |
num.elettroni |
s |
2 |
p |
6 |
d |
10 |
f |
14 |
Il numero degli elettroni in un sottolivello viene indicato in alto a destra. Es: 3p4
Pertanto la struttura elettronica di un atomo può anche essere scritta in modo abbreviato sfruttando questa simbologia. Ad esempio il magnesio (Z = 12) ha la seguente struttura elettronica:
1s22s22p63s2
Vi è una complicazione quando si va a collocare gli elettroni sul terzo livello energetico (n=3). In base alla tabella sopra scritta nel terzo livello c'è posto per tre sottolivelli, s, p e d e quindi c'è posto per 18 elettroni. Ma l'energia del sottolivello 3d è maggiore dell'energia del sottolivello 4s, e quindi 3d si riempie dopo 4s.
-l £ m £ +l incluso lo zero
Ad esempio per gli orbitali s, m=0 cioè m non ha significato, infatti tali orbitali, essendo sferici, non presentano alcun orientamento particolare. Invece, per gli orbitali p esistono tre valori di m: -1, 0, +1. Esistono quindi tre orientamenti nello spazio che corrispondono ai tre assi cartesiani che vengono indicati con px, py, pz . Per gli orbitali d esistono 5 valori di m mentre per quelli di tipo f se ne hanno 7.
Il significato di questo numero quantico è che mentre l’elettrone si muove nello spazio definito da un orbitale atomico, gira anche su se stesso. Poiché i versi delle possibili rotazioni sono due, convenzionalmente lo spin viene indicato con il numero relativo +1/2 se la rotazione avviene in senso orario (ed in questo caso viene indicato con una freccia rivolta verso l’alto) o -1/2 se la rotazione avviene in senso antiorario(ed in questo caso viene indicato con una freccia rivolta verso il basso ¯).
Nota: la sfera del sottolivello s non è perfetta . L'ombreggiatura è più marcata dove maggiore è la probabilità di trovare l'elettrone.
Ogni orbitale viene rappresentato con un quadretto e all’interno del quadretto si indica l’elettrone con una freccia la cui direzione indica lo spin. Lo spin del primo elettrone viene indicato con la freccia verso il basso (-1/2).
Regole di riempimento degli orbitali
Il principio che regola la progressiva sistemazione degli elettroni secondo il modello quanto-meccanico si articola in tre norme fondamentali:
1) Gli elettroni che debbono essere aggiunti per passare da un elemento a quello successivo vanno sistemati nell'orbitale con il livello più basso di energia disponibile. Ad esempio passando dall'elio, che ha due elettroni nell'orbitale 1s, al litio, che ha un elettrone in più , tale elettrone andrà a collocarsi nell'orbitale 2s che ha minor energia degli orbitali 2p.
Orbitali che hanno lo stesso valore di n e l hanno la stessa energia, cioè al variare dell’orientamento (m) l’energia non cambia, tanto meno l’energia dipende dallo spin dell’elettrone. Infine, come regola generale, occorre ricordare anche che se si hanno due orbitali con differenti valori di n e l, per valutare quali dei due ha energia superiore basta far riferimento a quali dei due ha la somma dei valori di n e l maggiore. Ad esempio l’orbitale 3d (n=3, l=2) ha energia maggiore dell’orbitale 4s
(n = 4, l = 0) perché la somma (3+2) è maggiore di (4+0). Nel caso in cui gli orbitali hanno la somma di n e l ugual, spetta energia maggiore all’orbitale con il valore di n più elevato.
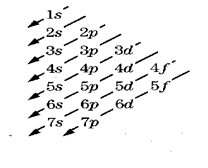
Una regola pratica per valutare l’ordine progressivo della energia dei singoli orbitali, denominata anche regola della diagonale è schematizzata nella figura.
2). Un principio detto di esclusione di Pauli afferma che "ogni orbitale può essere occupato da un massimo di due elettroni avente diverso spin". Poiché i due elettroni che sono nello stesso orbitale hanno i primi tre numeri quantici uguali, il principio di Pauli può essere così riformulato "non esistono due elettroni con i quattro numeri quantici uguali”. Un elettrone in un singolo orbitale si dice anche spaiato e vien indicato con la freccia verso l’alto.
3) Regola di Hund: Gli elettroni tendono ad occupare il maggior numero possibile di orbitali vuoti. Infatti se più orbitali di uguale energia fossero disponibili, l'elettrone occupa quello non ancora occupato da un altro elettrone e gli spin di tali elettroni sono paralleli.
Es: Scrivere la configurazione elettronica del cadmio:
1s22s22p63s23p64s23d104p65s24d10
ENERGIA DI IONIZZAZIONE
Def: Viene chiamata energia di prima ionizzazione Ei' la quantità minima di energia che occorre spendere per togliere ad un atomo un elettrone, quello legato più debolmente, e formare così un catione cioè uno ione positivo.
L'energia di prima ionizzazione dipende dall'elemento chimico considerato poiché:
Quelle indicate sono le energie di prima ionizzazione in eV dei primi 40 elementi. Questi dati, che sono stati ottenuti con elementi allo stato gassoso hanno permesso di capire come sono disposti gli elettroni attorno ad un atomo.
L'andamento dell'energia è irregolare è "a picchi" vale a dire che ogni volte che Ei' raggiunge un valore massimo, subito dopo si ha un minimo. Come spiegare questo strano andamento?
In base all'indicazione a) avremo dovuto prevedere un aumento continuo dei valori di Ei' dal momento che Z , cioè la carica positiva del nucleo, cresce progressivamente e che l'elettrone da togliere sarebbe quindi maggiormente attratto dal nucleo.
Riferendoci però anche all'indicazione (b) si può dare una spiegazione all'andamento apicchi dei valori di Ei'; ogni valore minimo di Ei' che segue immediatamente un valore massimo, vuol significare che l'elettrone strappato all'atomo si deve necessariamente trovare ad una distanza dal nucleo maggiore di quella dell'atomo precedente.
Queste considerazioni giustificano il modello atomico a livelli di energia, la cui versione più raffinata è il modello ad orbitali già esaminato: "Gli elettroni compiono il loro movimento intorno al nucleo disponendosi su determinati livelli che si trovano a distanze diverse dal nucleo e ai quali corrispondono precisi valori di energia". Inoltre "gli elettroni occupano via via i livelli a partire da quello più vicino al nucleo e solo quando un livello è completo passano a quello successivo. Analizzando il grafico so osserva che gli elettroni si distribuiscono su 7 livelli (che non corrispondono esattamente al numero quantico n!) ciascuno dei quali può ospitare al massimo un numero ben definito di elettroni.
livello |
n.max di elett. |
1 |
2 |
2 |
8 |
3 |
8 |
4 |
18 |
5 |
18 |
6 |
32 |
7 |
? |
IL SISTEMA PERIODICO DEGLI ELEMENTI
Il grafico mostra come si dispongono progressivamente gli elementi nei livelli e suggerisce un analogo criterio per mettere in ordine gli elementi. Il sistema finale è la tavola periodica degli elementi. Innanzitutto gli elementi nella tavola sono sistemati in base al numero atomico crescente, ma la cosa più importante è la lunghezza delle righe della tabella. Infatti ogni riga contiene un numero variabile di caselle e quindi di elementi e questo numero corrisponde esattamente al numero di elettroni dei vari livelli. Per esempio nella terza riga ci sono 8 elementi, esattamente come sono 8 gli elettroni che possono trovare posto nel 3° livello. Inoltre ogni riga termina con un atomo che ha un numero di elettroni tali da completare il corrispondente livello energetico (sono i picchi del grafico). Pertanto i livelli orizzontali cioè i periodi sono 7. In uno stesso periodo le proprietà degli elementi variano gradualmente. Gli elementi allineati sulla medesima colonna costituiscono i gruppi. Questi hanno una doppia numerazione. La numerazione da 1 a 18 è quella consigliata dalla IUPAC, l'altra che utilizza i numeri romani individua solo 8 gruppi, vedremo perché. Sperimentalmente si verifica che gli elementi appartenenti allo stesso gruppo hanno proprietà simili. Ad esempio consideriamo gli elementi del primo gruppo chiamati metalli alcalini. L'aggettivo alcalino deriva dall'arabo e significa "ceneri di piante"; infatti le ceneri contengono molto sodio e potassio. Essi manifestano proprietà tipicamente metalliche come l'alta conducibilità elettrica e termica e la lucentezza ma a differenza degli altri metalli sono molli. Sono anche molto reattivi con l'acqua liberando idrogeno:
2Na + 2H2O >>>> 2 NaOH + H2
Essendo molto reattivi, per conservarli vengono posti nel petrolio. Dobbiamo ricercare il motivo di queste somiglianze nella struttura elettronica. In base alle indicazioni dateci dal grafico risulta chiaro che "tutti gli atomi degli elementi del primo gruppo hanno un unico elettrone nel livello più esterno occupato, in particolare tale elettrone si trova nell'orbitale s ". Infatti:
litio 1s22s1 2S1 = configurazione elettronica esterna
sodio [Ne]3s1 la configurazione elettronica del sodio è quella del neon + 1 elettrone in 3s
Potassio [Ar]4s1
La loro alta reattività è dovuta al basso valore della Ei' e ciò sta ad indicare che questi elementi sono facilmente ionizzabili, ossia tendono a perdere l'elettrone esterno con notevole facilità, assumendo in questo modo la configurazione elettronica del gas nobile immediatamente precedente. Da notare che gli ioni che si formano presentano comportamenti chimici differenti da quelli dei relativi atomi. Infatti il sodio ,atomico a contatto con l'acqua presenta proprietà esplosive, mentre lo ione Na+, contenuto ad esempio nel sale da cucina, non reagisce così violentemente con con l'acqua, infatti viene tranquillamente sciolto nei brodi, nelle minestre.
E' facile verificare che tutti gli elementi del gruppo 2 detti alcalino terrosi presentano nella loro configurazione esterna, due elettroni appartenenti a un orbitale s. Concludendo:
Le proprietà degli elementi sono strettamente connesse alla configurazione elettronica esterna dei suoi atomi. Analoghe configurazioni esterne determinano, perciò, comportamenti chimici simili. |
Gli elettroni di valenza
Risulta chiaro che gli elettroni appartenenti alla configurazione esterna assumono una grande importanza nelle reazioni chimiche. Per questo motivo, si è pensato di distinguerli dagli altri elettroni.
def :Gli elettroni esterni di un atomo vengono definiti elettroni di valenza.
Oss1: Il numero di elettroni di valenza di un atomo coincide con il numero romano che indica il gruppo in cui si trova l'elemento stesso. Per gli elementi che appartengono ai gruppi da 3 a 12, non possiamo dedurre gli elettroni di valenza per la complessità della struttura elettronica.
Oss 2: Gli elettroni di valenza si rappresentano con dei puntini intorno al simbolo dell'elemento dell'atomo. In questa rappresentazione detta simbolismo di Lewis, (chimico statunitense) a ogni puntino equivale un elettrone. Alcune volte due puntini vengono sostituiti da una lineetta. Questa notazione è utile per descrivere i modelli di legame chimico.
Oss 3: Quando parliamo di elettroni di valenza ci si riferisce agli elettroni di tipo s o p.
Tutti gli elementi dal terzo all'11°mo gruppo che corrispondono al riempimento del sottolivello d vengono indicati con il termine di metalli di transizione; sono elementi che hanno proprietà simili (duri e altofondenti) pur avendo una configurazione esterna differente e questo dimostra che gli elettroni che non appartengono agli orbitali s o p non influenzano in modo apprezzabile le proprietà chimiche dei rispettivi elementi.
Gli elementi che corrispondono al riempimento del sottolivello 4f , che può contenere fino a 14 elettroni, sono metalli abbastanza rari (ciò giustifica la scelta di riportarli al margine della tabella) che hanno proprietà simili, chiamati lantanidi (prendono il nome dal primo elemento della serie); Sotto la fila dei lantanidi troviamo gli attinidi, elementi quasi tutti di origine artificiale, instabili e radioattivi, che corrispondono agli elettroni del sottolivello 5f. Lantanidi e attinidi costituiscono le cosiddette terre rare.
Anche gli elementi del gruppo 18 costituiscono una famiglia con proprietà simili. Si trovano tutti allo stato gassoso, in condizioni ordinarie, ed hanno scarsissima tendenza a reagire con altri elementi. Infatti sono gli unici elementi gassosi costituiti da singoli atomi isolati e per tale motivo sono detti gas nobili. La particolarità della struttura elettronica degli atomi dei gas nobili sta nel fatto che, ad eccezione dell'elio, riempiono con 8 elettroni il livello più esterno. L'insieme costituito da questi elettroni di valenza viene denominato ottetto.
L'energia di prima ionizzazione del sodio è di 5.14 eV. Qual è l'equazione che rappresenta correttamente il processo ? L'atomo di sodio perde l'elettrone per uno di questi processi:
L'atomo non è allora più neutro ma assume una carica positiva pari al numero di elettroni persi. Si forma uno ione positivo cioè un catione, secondo la reazione:
Na + Ei' >>>> Na+ +e-
Questa equazione ci dice che se un atomo di sodio assorbe un'energia di 5.14 eV si trasforma in uno ione positivo liberando un elettrone. Nella pratica quotidiana, tuttavia, risulta impossibile ragionare in termini di atomi o di elettroni, in quanto queste particelle sono invisibili e non pesabile. Ecco allora che non ci si riferisce alle singole particelle, ma a un loro insieme, è stata così introdotta la mole:
Una mole di un composto è la quantità di composto, espressa in grammi, numericamente uguale alla sua massa molecolare relativa. |
I coefficienti stechiometrici rappresentano anche il numero di moli che intervengono nella reazione. Ecco allora che la reazione precedente può essere letta nel seguente modo:
Per ogni mole di sodio che assorbe X eV/mole di energia si formano una mole di ione sodio e una mole di elettroni.
Una mole di qualsiasi sostanza contiene sempre lo stesso numero di particelle, pari a |
5.14 eV/elettrone = 5.14 x 1.6 x 10-19 Joule/elettrone =
= 8.22 x 10-19 Joule/elettrone x 6.02 x1023 elettroni/mole = 49.5 x 104 Joule/mole
Es1: Quali sono le masse di 2 moli d'acqua e di 0.5 moli di fosforo atomico? Quante particelle sono contenute in tali moli ?
acqua P.M. = 18 u una mole d'acqua pesa 18 grammi e contiene No molecole
1 mol : 18 g = 2 mol : Xg X = 36 g che contengono 12.04x1023 molecole
fosforo P.M. = 31 u X = 15.5 g
Es 2: Quanti moli ci sono in 360 g di acqua ?
1 mole : 18 g = n : 360 g n = 20 mol
Es 3: La seguente reazione permette la preparazione dell'ossigeno dal clorato di potassio
2 KClO3 >>>> 2KCl +302
KClO3 = PM 122.6 u
O2 = PM 32 u
2x122.6g : 3x32g = 10g : X X = 960/245.2 = 3.9 g
Energia di seconda, terza.. ionizzazione
I valori delle energie di ionizzazione relative alla estrazione successiva dei tre elettroni del litio sono:
Li + 520 Kj/mol >>>> Li+ + e-
Li+ + 7297 Kj/mol >>>> Li++ + e-
Li++ + 11 816 Kj/mol >>>> Li+++ + e-
L'energia necessaria per togliere il secondo elettrone dal nucleo e circa 14 volte quella più grande di quella necessaria per togliere il primo. Dato che il nucleo è lo stesso questa differenza la si può spiegare soltanto con una diversa distanza elettrone nucleo, per cui si può concludere che questo secondo elettrone non si trova nel secondo livello ma nel primo. In questo livello si trova anche il terzo e ci si dovrebbe aspettare due valori uguali, invece Ei''' è maggiore di Ei'' perchè? Oltre alla forza di attrazione elettrone nucleo intervengono anche le forze di repulsione tra elettroni. La presenza quindi di altri elettroni, oltre a quello che si toglie, rende più debole la forza di attrazione e porta quindi ad una minor energia di ionizzazione.
AFFINITA' ELETTRONICA
L'instabilità elettronica non è una prerogativa dei metalli alcalini. In realtà anche gli elementi che che precedono immediatamente i gas nobili, ossia gli alogeni (F, Cl,Br, I) tendono a modificare facilmente il loro assetto elettronico esterno, anche se la loro Ei' risulta piuttosto alta. In questo caso l'atomo preferisce acquistare un elettrone, assomigliando in questo modo allo strato più esterno al gas nobile che lo segue.. Questo comportamento chimico degli alogeni viene precisato nel seguente modo:
def: Si definisce affinità elettronica Ae l'energia che viene scambiata quando si aggiunge un elettrone ad un atomo.
Oss1: Quanto più alto è il valore dell'affinità elettronica di un atomo, tanto maggiore risulta la sua tendenza ad acquistare elettroni cioè a trasformarsi in uno ione negativo.
Oss 2: La formazione di uno ione negativo chiamato anche anione avviene attraverso una reazione come questa riferita al cloro:
Cl + 1e- >>>> Cl- + Ae
Oss 3: Anche Ae (così come Ei) mostra un andamento periodico. All'interno di un periodo l'affinità elettronica ha inizialmente valori molto piccoli e ciò sta ad indicare una scarsissima tendenza ad acquistare elettroni. Verso la fine del periodo, in particolare negli ultimi tre elementi prima del gas nobile si ha invece un forte aumento di Ae il che indica una tendenza crescente ad assumere elettroni ( vedi grafico dell'andamento dei valori dell'affinità elettronica per gli elementi della tavola periodica in funzione del loro numero atomico )
Oss4 : E' necessario far notare che si Ae che Ei sono grandezze ottenute studiando atomi isolati. La maggior o minor attrazione degli elettroni negli atomi legati tra di loro prende invece il nome di elettronegatività e verrà studiata più avanti.
IL CARATTERE METALLICO
Abbiamo già osservato che una linea a scaletta che parte dal boro (B) e finisce nell'astato (At) divide gli elementi della tavola periodica in due famiglie: a destra della scaletta si hanno i non metalli e a sinistra i metalli. Gli elementi che si trovano in prossimità della suddetta linea di separazione sono denominati semimetalli o semiconduttori.
Pertanto ogni periodo inizia con un metallo e termina sempre con un non metallo. Studiando le variazioni di Ei e di Ae, si può dare alle parole metallo e non metallo un significato più chimico.
I metalli presentano bassi valori di Ei e di Ae e questo significa che negli atomi di questi elementi le forze attrattive tra elettroni esterni e nucleo sono deboli. Quindi gli elementi che hanno il maggior carattere metallico sono quelli appartenenti ai primi due gruppi.
Viceversa, sono non metalli gli elementi i cui elettroni esterni sono fortemente attratti dal nucleo (alta Ei) e che sono disposti a ricevere eventualmente anche altri elettroni (alta Ae).
Poiché sia Ei che Ae cambiano gradualmente lungo un periodo, non è possibile stabilire confini netti tra metalli e non metalli, ecco allora giustificata la, presenza dei semimetalli.
STABILITA' DEGLI IONI E NOMENCLATURA
Nel 1916 Lewis propose la sua ipotesi dell'ottetto, secondo la quale la reattività degli atomi si può classificare in base alla loro tendenza a raggiungere l'ottetto (8 elettroni) nel guscio più esterno, quando esso sia incompleto. Così il sodio perdendo un elettrone si trasforma in uno ione positivo e realizza una configurazione stabile avendo raggiunto l'ottetto nel guscio sottostante. Il cloro acquistando un elettrone, diventa uno ione negativo e anch'esso completa l'ottetto nel guscio più superficiale.
Per quanto riguarda la nomenclatura degli ioni si usa il seguente criterio:
Moltissime sostanze esistono allo stato di ioni. Ad esempio essi sono presenti in quasi tutte le soluzioni acquose. Leggendo l'etichetta di una bottiglia di acqua minerale si può verificare quanti ioni e in quale concentrazione sono presenti in essa. I dentifrici al fluoro contengono gli ioni F-. Il più piccolo ione è lo ione idrogeno H+: è molto reattivo, infatti sia associa facilmente alla molecola dell'acqua formando lo ione ossonio H3O+.
Tra gli ioni poliatomici molto noti sono: ione ammonio NH4+, ione nitrato NO3- .
NUMERI QUANTICI ED ORBITALI ATOMICI
Abbiamo detto che gli elettroni non si muovono attorno al nucleo su orbite ben definite ma ruotano in regioni, chiamate orbitali, dove è alta la probabilità di trovarli. Ciascun orbitale è individuato da 4 numeri che per la loro caratteristica di assumere valori ben precisi vengono chiamati quantici. Il primo numero detto principale è stato definito osservando il diagramma delle energie di ionizzazione. Tale diagramma ci ha permesso di scoprire che gli elettroni si trovano a diversa distanza dal nucleo. In particolare si possono individuare 7 distanze o livelli principali, chiamati anche gusci. Ad ognuno di tale livelli assegniamo il numero quantico principale n intero positivo. Tale numero definisce quindi la distanza media dell’elettrone dal nucleo e la sua energia. (disegna il livelli principali)
Fonte: http://www.fisicaweb.org/doc/atomo/numeri%20quantici.doc
Sito web da visitare: http://www.fisicaweb.org/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve