I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
1. Introduzione.
Tutti i corpi condensati sono separati dall’ambiente circostante per mezzo di una superficie. In corrispondenza di questa superficie di separazione, la disposizione delle molecole è necessariamente diversa da quella, di minima energia, che caratterizza invece la parte interna del corpo. Pertanto, sulla superficie del corpo si può pensare che si accumuli una energia potenziale, chiamata energia superficiale, ![]() . Va notato che la superficie a cui si riferisce l’energia superficiale non è da intendersi in senso strettamente matematico (cioè come una varietà avente solo due dimensioni e spessore nullo); in realtà tale superficie corrisponde, fisicamente, ad alcuni strati di molecole. Il rapporto tra l’energia superficiale del corpo e l’area della superficie del corpo, ovvero l’energia superficiale per unità di superficie si chiama tensione superficiale del corpo e si indica con
. Va notato che la superficie a cui si riferisce l’energia superficiale non è da intendersi in senso strettamente matematico (cioè come una varietà avente solo due dimensioni e spessore nullo); in realtà tale superficie corrisponde, fisicamente, ad alcuni strati di molecole. Il rapporto tra l’energia superficiale del corpo e l’area della superficie del corpo, ovvero l’energia superficiale per unità di superficie si chiama tensione superficiale del corpo e si indica con ![]() . Le sue unità di misura, nel sistema SI, sono
. Le sue unità di misura, nel sistema SI, sono ![]() ovvero
ovvero ![]() ; notiamo che la tensione superficiale può anche essere interpretata come la forza agente per unità di lunghezza. E’ importante riconoscere che la tensione superficiale si riferisce ad una energia di tipo meccanico, non termico, ed è pure importante sottolineare la differenza tra energia superficiale e tensione superficiale: la prima si ottiene moltiplicando la seconda per l’area della superficie. E’ poi evidente che la tensione superficiale è definita solo per solidi e liquidi dato che i gas non hanno una superficie che li delimiti. Per i solidi cristallini, inoltre, la valutazione degli effetti superficiali è resa più complessa dal fatto che la tensione superficiale è in generale diversa per facce cristalline differenti.
; notiamo che la tensione superficiale può anche essere interpretata come la forza agente per unità di lunghezza. E’ importante riconoscere che la tensione superficiale si riferisce ad una energia di tipo meccanico, non termico, ed è pure importante sottolineare la differenza tra energia superficiale e tensione superficiale: la prima si ottiene moltiplicando la seconda per l’area della superficie. E’ poi evidente che la tensione superficiale è definita solo per solidi e liquidi dato che i gas non hanno una superficie che li delimiti. Per i solidi cristallini, inoltre, la valutazione degli effetti superficiali è resa più complessa dal fatto che la tensione superficiale è in generale diversa per facce cristalline differenti.
La prima evidente conseguenza della esistenza della tensione superficiale è che un liquido, se non è costretto in un recipiente, forma gocce più o meno sferiche; a parità di volume, infatti, la sfera è il solido che ha la superficie minima (proprietà isoperimetrica).
In seguito illustreremo alcune conseguenze della tensione superficiale con riferimento a fasi liquide costituite da una sola specie chimica.
2. Fenomeni di capillarità.
Un fenomeno molto comune legato alla tensione superficiale dei liquidi è l’innalzamento capillare. Esso consiste nel fatto che immergendo parzialmente un tubo capillare (cioè di sezione molto piccola) in un liquido, questo risale lungo il tubo capillare, contro la gravità, fino ad una certa altezza h, Fig. 1(a). Il fenomeno si verifica solo per quei liquidi che bagnano il capillare; ad esempio, se il capillare è di vetro, il fenomeno non si verifica con il mercurio.
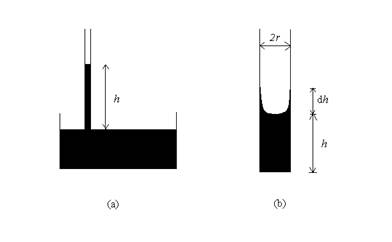
Fig. 1. Illustrazione del fenomeno della capillarità
Analizziamo il fenomeno qualitativamente. Se il liquido bagna il capillare allora si può pensare che lungo la parete del tubo si formi uno strato di liquido, aderente alla parete, al di sopra del livello. Il particolare è esaltato nella figura 1(b).
La tendenza del liquido a risalire lungo il capillare è, allora, presto spiegata. Infatti, se il livello del liquido si alza di dh, l’area superficiale del liquido diminuisce di una quantità pari alla superficie laterale del cilindro di altezza dh e raggio r, che è ![]() . Conseguentemente, l’energia superficiale del liquido diminuisce di una quantità uguale a
. Conseguentemente, l’energia superficiale del liquido diminuisce di una quantità uguale a
![]() (1)
(1)
D’altra parte, l’innalzamento del liquido dal livello h al livello h+dh comporta un aumento di energia potenziale gravitazionale uguale al lavoro fatto dalla forza di gravità per sollevare di dh la colonna di liquido. Si ottiene
![]() (2)
(2)
In condizioni di equilibrio le due quantità precedentemente ricavate si equivalgono e quindi la colonna di liquido di altezza h è stabile. Si ricava allora
![]() (3)
(3)
da cui, semplificando,
![]() (4)
(4)
o anche
![]() (5)
(5)
con
![]() (6)
(6)
detta costante di capillarità. La (5) mostra che l’altezza del liquido nel capillare è inversamente proporzionale al raggio del capillare ed è direttamente proporzionale alla tensione superficiale del liquido. Si riportano, nella tabella sottostante, i valori di tensione superficiale di alcuni liquidi
Composto |
g ( |
Acqua |
0.073 |
Etanolo |
0.022 |
Benzene |
0.029 |
Etere etilico |
0.017 |
Notare che la (4) offre un metodo per la determinazione della tensione superficiale dei liquidi. In pratica occorre misurare l’altezza h raggiunta dalla colonna di liquido e conoscerne la densità.
La (5) può essere ricavata anche in un altro modo, che ora esporremo. Se il liquido ”bagna” il capillare, vuol dire che esiste una affinità tra il liquido e la superficie del capillare, sicché il liquido è tirato verso l’alto in corrispondenza della superficie di contatto con il vetro, e la superficie del liquido si deforma.
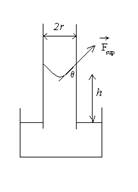
Figura 2. Angolo di contatto e innalzamento capillare
Sia q l’angolo formato, nel punto di contatto, dalla tangente alla superficie del liquido con la direzione verticale. Tale angolo si chiama angolo di contatto ed è caratteristico per la coppia liquido-superficie. Nel caso rappresentato in figura 2, l’angolo di contatto è minore di 90°, il che si verifica per tutti i liquidi che bagnano una determinata superficie. Si può ritenere che sulla colonna di liquido di altezza h agiscano due forze. Una, diretta verticalmente in alto, è la componente verticale della forza superficiale. Considerato che la tensione superficiale è forza per unità di lunghezza, e che la sezione del capillare è una circonferenza di raggio r, si ha che tale componente verticale è data da
![]() (7)
(7)
La seconda è la forza peso agente sulla colonna di liquido di altezza h. Essa è data da
![]() (8)
(8)
In condizioni di equilibrio le due forze si eguagliano
![]() (9)
(9)
da cui si trae
![]() (10)
(10)
che è l’espressione generalizzata della (5), includente l’angolo di contatto. Si vede che per ![]() , cioè per liquidi che ”bagnano” il capillare, è h>0, cioè si ha innalzamento capillare; in questo caso, che è quello più frequentemente osservato, la forma del menisco di liquido è concava. Per
, cioè per liquidi che ”bagnano” il capillare, è h>0, cioè si ha innalzamento capillare; in questo caso, che è quello più frequentemente osservato, la forma del menisco di liquido è concava. Per ![]() è h=0 sicchè non si ha innalzamento capillare e la forma della superficie di liquido è piana. Infine, per
è h=0 sicchè non si ha innalzamento capillare e la forma della superficie di liquido è piana. Infine, per ![]() , si ha addirittura h<0, cioè si ha un abbassamento del liquido nel capillare rispetto alla quota di riferimento. In questo caso la forma del menisco di liquido è convessa. Valutiamo, con la (10), l’altezza raggiunta dall’acqua in un capillare di vetro. Si ha
, si ha addirittura h<0, cioè si ha un abbassamento del liquido nel capillare rispetto alla quota di riferimento. In questo caso la forma del menisco di liquido è convessa. Valutiamo, con la (10), l’altezza raggiunta dall’acqua in un capillare di vetro. Si ha
![]()
da cui, sostituendo, è
![]()
Per un tubo capillare di raggio ![]() si valuta
si valuta ![]() , mentre per un capillare di
, mentre per un capillare di ![]() si valuta
si valuta ![]() .
.
2. Pressione interna di gocce e bolle: equazione di Laplace.
Quando due fasi diverse sono a contatto fra loro in condizioni di equilibrio termodinamico, le pressioni dai due lati della superficie di separazione devono essere uguali. Questa circostanza, che scaturisce, evidentemente, da una condizione di equilibrio meccanico, presupposto dell’equilibrio termodinamico, vale anche se si considerano effetti legati alla tensione superficiale purché, però, la superficie di separazione tra le fasi sia piana. Se, invece, essa è curva la condizione viene a cadere e si manifesta una differenza di pressione attraverso la superficie di separazione tra le fasi, legata alla tensione superficiale.
L’effetto si presenta, ad esempio, nel caso della formazione di bolle o gocce.
Consideriamo la formazione di una goccia (o di una bolla) all’interno di una fase. Sia r il raggio della goccia.
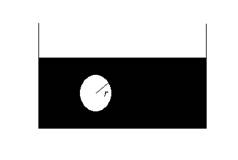
Figura 3. Formazione di una bolla all’interno di una fase.
Supponiamo che un volume dV di liquido venga trasferito dalla fase esterna all’interno della goccia (o bolla), per modo che il volume della goccia (o bolla) aumenti di dV. Poiché la goccia si espande, essa compie un lavoro sull’ambiente esterno e questo significa che la pressione interna della goccia, ![]() , deve essere maggiore di quella esterna,
, deve essere maggiore di quella esterna, ![]() . Il lavoro compiuto dal sistema è
. Il lavoro compiuto dal sistema è
![]() (11)
(11)
Ora, essendo
![]() (12)
(12)
si ha, differenziando,
![]() (13)
(13)
sicché è
![]() (14)
(14)
D’altra parte, se il raggio della goccia, a causa dell’incremento di volume, aumenta di dr, l’area della superficie della sfera, ![]() , aumenta di
, aumenta di ![]() , e l’energia superficiale aumenta di
, e l’energia superficiale aumenta di
![]() (15)
(15)
In definitiva, l’aumento del raggio della goccia da r a r+dr, da un lato diminuisce l’energia del sistema di una quantità data dalla (14), lavoro di espansione, e dall’altra la aumenta di una quantità data dalla (15), aumento di energia superficiale. La condizione di equilibrio si ha uguagliando (14) e (15) e corrisponde alla stabilità della goccia (o bolla) di raggio r. Si ha
![]() (16)
(16)
a quo, semplificando,
![]() (17)
(17)
La (17) fu ricavata nel 1806 da Laplace nel suo famoso trattato di Meccanica Celeste ed è appunto chiamata equazione di Laplace. Essa mostra che la pressione all’interno di una goccia (o bolla), in condizioni di equilibrio, è maggiore di quella esterna, a causa della tensione superficiale del liquido. Ovviamente, nel caso di una bolla, l’eccesso di pressione interna è doppio rispetto alla goccia, dato che entrambe le superfici che delimitano lo strato di liquido contribuiscono alla energia superficiale. Dalla (13) si vede che per ![]() , cioè per una superficie piana, è
, cioè per una superficie piana, è ![]() , ovvero non c’è differenza di pressione tra i due lati della superficie. D’altra parte, per
, ovvero non c’è differenza di pressione tra i due lati della superficie. D’altra parte, per ![]() , è
, è ![]() , ovvero l’eccesso di pressione interna è divergente. La (17) vale nel caso particolare di una superficie sferica. Più in generale, vale la seguente equazione
, ovvero l’eccesso di pressione interna è divergente. La (17) vale nel caso particolare di una superficie sferica. Più in generale, vale la seguente equazione
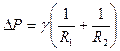 (18)
(18)
che esprime la differenza di pressione ![]() attraverso l’interfaccia tra due fluidi in condizioni di equilibrio statico, dovuta al fenomeno della tensione superficiale.
attraverso l’interfaccia tra due fluidi in condizioni di equilibrio statico, dovuta al fenomeno della tensione superficiale. ![]() ed
ed ![]() sono i raggi di curvatura principali della superficie di separazione tra i due fluidi. La (18) si ottiene imponendo il bilancio degli sforzi normali alla interfase per i due fluidi in equilibrio statico, laddove l’interfase è trattata come una superficie (spessore nullo). E’ ovvio che per una interfase sferica la (18) si riduce alla (17). In sostanza si può dire che ogniqualvolta due fasi fluide differenti sono tra loro a contatto in condizioni di equilibrio statico, vale la (18); se, in particolare, l’interfase è planare, non c’è differenza di pressione dai due lati dell’interfase, se invece l’interfase è non planare, allora si stabilisce una differenza di pressione tra le due facce dell’interfase, che in condizioni di equilibrio è data dalla (18).
sono i raggi di curvatura principali della superficie di separazione tra i due fluidi. La (18) si ottiene imponendo il bilancio degli sforzi normali alla interfase per i due fluidi in equilibrio statico, laddove l’interfase è trattata come una superficie (spessore nullo). E’ ovvio che per una interfase sferica la (18) si riduce alla (17). In sostanza si può dire che ogniqualvolta due fasi fluide differenti sono tra loro a contatto in condizioni di equilibrio statico, vale la (18); se, in particolare, l’interfase è planare, non c’è differenza di pressione dai due lati dell’interfase, se invece l’interfase è non planare, allora si stabilisce una differenza di pressione tra le due facce dell’interfase, che in condizioni di equilibrio è data dalla (18).
Applichiamo la (17) al caso della formazione di bolle in aria,![]() . Se la superficie delle bolle è acqua, si ha
. Se la superficie delle bolle è acqua, si ha
![]()
Si valutano le seguenti pressioni interne
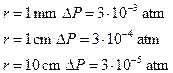
L’aggiunta all’acqua di particolari sostanze (tensioattivi o surfattanti) determina un forte abbassamento della tensione superficiale. Tipici tensioattivi sono i saponi. Per un’acqua saponata si valuta![]() , quindi un valore 10 volte più basso rispetto all’acqua pura. In base all’equazione di Laplace, l’eccesso di pressione interna, a parità di raggio, è più piccolo, e quindi le bolle si formano più facilmente. Ad esempio si valuta
, quindi un valore 10 volte più basso rispetto all’acqua pura. In base all’equazione di Laplace, l’eccesso di pressione interna, a parità di raggio, è più piccolo, e quindi le bolle si formano più facilmente. Ad esempio si valuta
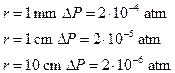
Consideriamo la formazione di bolle in un liquido al punto di ebollizione. Come noto, l’ebollizione si verifica alla temperatura alla quale la tensione di vapore del liquido eguaglia la pressione esterna. Ciò, però, non tiene conto di effetti superficiali. Infatti, anche quando si è raggiunta la situazione in cui la tensione di vapore eguaglia la pressione esterna, le bolle di vapore che si formano in seno al liquido hanno, inizialmente, un raggio molto piccolo sicché, per la (13), la loro pressione interna sarebbe talmente elevata da farle ”esplodere”, sicché esse non potrebbero essere stabili. In pratica, le bolle si formano attorno a particelle solide (impurezze) eventualmente presenti nel liquido, in modo da avere un raggio iniziale maggiore e quindi un eccesso di pressione interna inferiore. In assenza di impurezze si può avere surriscaldamento del liquido anche di parecchi gradi, prima della ebollizione. Una volta che le bolle scappano dal liquido esse si rompono. Ciò avviene per due motivi. Anzitutto, una volta abbandonato il liquido esse si trovano esposte ad una pressione esterna più bassa di quella di equilibrio in cui si erano formate, quindi sono instabili, dovendo ingrandirsi; in secondo luogo il liquido che costituisce la superficie della bolla comincia ad evaporare e quindi la bolla a contrarsi sempre più.
3. Tensione di vapore di piccole gocce di liquido: equazione di Kelvin.
L’equilibrio tra un liquido ed il proprio vapore, ad una certa temperatura, si realizza quando il potenziale chimico del liquido eguaglia quello del vapore. In questa situazione, la pressione del vapore in equilibrio col liquido è chiamata tensione di vapore. Ora, il potenziale chimico del gas è indipendente dalla superficie di separazione. D’altra parte, il potenziale chimico del liquido dipende dalla superficie, dato che i liquidi hanno una tensione superficiale non nulla, sicché, se la superficie del liquido è molto elevata possono presentarsi effetti significativi sull’equilibrio liquido-gas. Un caso del genere si presenta quando il liquido è sotto forma di piccole gocce (per esempio è nebulizzato), e noi vogliamo adesso studiare questi effetti.
Il differenziale dell’energia libera di Gibbs, in presenza di effetti superficiali, è dato da
![]() (19)
(19)
in cui ipotizziamo la presenza di un solo componente. Con s si intende l’area della superficie del sistema. Dalla (19), e dal teorema del differenziale totale, si ricava l’espressione del potenziale chimico, che è
![]() (20)
(20)
Essa, come si vede, si riferisce ad un trasferimento di materia mediante un processo che non faccia variare la superficie s. Ciò è soddisfatto nel caso di trasferimento di materia attraverso una superficie piana (ovvero a raggio di curvatura infinito), sicché, esplicitando scriviamo
![]() (21)
(21)
che sostituiamo nella (19) ottenendo
![]() (22)
(22)
Nel caso di una goccia sferica, invece, le variabili s e n della (19) e (22) non sono indipendenti, nel senso che una variazione dn del numero di moli di sostanza nella goccia comporta necessariamente una variazione ds della superficie della goccia stessa, e noi dobbiamo adesso ricavare l’espressione analitica di questa dipendenza. Supponiamo che una goccia di liquido, di raggio r, riceva dn moli di sostanza. Essendo
![]() (23)
(23)
in cui si è indicata con r la densità del liquido e con M la sua massa molare. Dalla (23), differenziando, è
![]() (24)
(24)
Ma è anche (goccia sferica)
![]() (25)
(25)
Eguagliando (24) e (25) si ha
![]() (26)
(26)
ovvero
![]() (27)
(27)
Ora, per la goccia sferica di raggio r, è
![]() (28)
(28)
Sostituendo nella (28) l’espressione di dr data dalla (27) si ottiene, dopo semplificazione,
![]() (29)
(29)
che è la relazione cercata tra le due variabili s e n. Sotituendo la (29) nella (22) si ottiene facilmente
![]() (30)
(30)
Il potenziale chimico della goccia è dato allora da
![]() (31)
(31)
ovvero
![]() (32)
(32)
La (32) dice che il potenziale chimico di un liquido in forma di goccia è maggiore di quello del liquido in superficie piana, a causa della tensione superficiale. Consideriamo ora l’equilibrio liquido-gas. La goccia di raggio r sia in equilibrio, alla temperatura T, con il proprio gas alla pressione P, che è quindi la tensione di vapore della goccia. D’altra parte, alla stessa temperatura, il liquido in geometria planare sia in equilibrio con il proprio vapore alla pressione ![]() , che è quindi la tensione di vapore normale del liquido. Ricordando che in condizione di equilibrio tra fasi il potenziale chimico delle due fasi deve essere uguale, e ricordando anche che il potenziale chimico di un gas rarefatto, alla temperatura T e pressione P, è dato da
, che è quindi la tensione di vapore normale del liquido. Ricordando che in condizione di equilibrio tra fasi il potenziale chimico delle due fasi deve essere uguale, e ricordando anche che il potenziale chimico di un gas rarefatto, alla temperatura T e pressione P, è dato da
![]() (33)
(33)
Si ha, sostituendo in (32) e sfruttando le proprietà dei logaritmi,
![]() (34)
(34)
ovvero
![]() (35)
(35)
o, equivalentemente,
![]() (36)
(36)
L’ equazione (36) fu ricavata da Thomson (Lord Kelvin) nel 1871 e prende il nome di equazione di Kelvin. Essa mostra che la tensione di vapore P di un liquido sotto forma di goccia di raggio r è maggiore di quella normale del liquido in disposizione piana, ![]() . La differenza è dovuta alla tensione superficiale del liquido ed è tanto maggiore quanto più è piccolo il raggio della goccia. L’andamento è rappresentato nella figura sottostante.
. La differenza è dovuta alla tensione superficiale del liquido ed è tanto maggiore quanto più è piccolo il raggio della goccia. L’andamento è rappresentato nella figura sottostante.
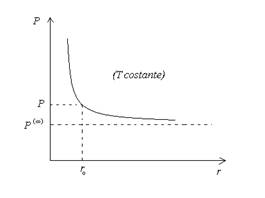
Figura 4. Dipendenza della tensione di vapore di una goccia di liquido dal suo raggio.
Proviamo ora a dare una descrizione qualitativa di quel che accade quando un gas comincia a condensare. In accordo con la (35), solo gocce di liquido di un determinato raggio possono esistere all’equilibrio a T e P assegnati. Sia ![]() questo raggio (vedi Fig. 4). Per gocce troppo grandi, la pressione esterna risulta maggiore; esse tendono allora a ridurre la pressione esterna raccogliendo vapore, il che le fa crescere ancora di più. Per gocce troppo piccole, invece, la pressione esterna P è troppo bassa; esse tendono quindi ad evaporare diventando ancora più piccole, fino a scomparire del tutto. Così, a meno che tutte le gocce non abbiano esattamente lo stesso raggio
questo raggio (vedi Fig. 4). Per gocce troppo grandi, la pressione esterna risulta maggiore; esse tendono allora a ridurre la pressione esterna raccogliendo vapore, il che le fa crescere ancora di più. Per gocce troppo piccole, invece, la pressione esterna P è troppo bassa; esse tendono quindi ad evaporare diventando ancora più piccole, fino a scomparire del tutto. Così, a meno che tutte le gocce non abbiano esattamente lo stesso raggio ![]() , il che è improbabile, si avrà che le gocce di raggio minore di
, il che è improbabile, si avrà che le gocce di raggio minore di ![]() scompaiono, mentre quelle di raggio maggiore di
scompaiono, mentre quelle di raggio maggiore di ![]() si ingrandiscono. Ciò si ottiene attraverso una condensazione netta del vapore sulle gocce, abbassando, in questo modo, la pressione del vapore. L’intero processo si ripete e si autosostiene, favorendo la formazione di gocce via via più larghe, fino a che tutto il liquido non formi un corpo unico di volume sostanzialmente infinito. A questo punto la pressione del vapore si abbassa a
si ingrandiscono. Ciò si ottiene attraverso una condensazione netta del vapore sulle gocce, abbassando, in questo modo, la pressione del vapore. L’intero processo si ripete e si autosostiene, favorendo la formazione di gocce via via più larghe, fino a che tutto il liquido non formi un corpo unico di volume sostanzialmente infinito. A questo punto la pressione del vapore si abbassa a ![]() , cioè la tensione di vapore di equilibrio.
, cioè la tensione di vapore di equilibrio.
Tutto questo nasconde, evidentemente un problema. Infatti, se immaginiamo che le gocce più grandi si formino per accrescimento di quelle più piccole, è chiaro che le prime molecole di gas, condensando, possono formare solo gocce di dimensioni molto piccole, minori di ![]() , per cui, in base all’equazione di Kelvin, esse dovrebbero vaporizzare, pervenendosi così all’assurdo che il gas non può condensare. In realtà, si avrà condensazione sulle pareti del recipiente o su particelle di polvere eventualmente presenti, mentre, in sistemi molto puri si può raggiungere un elevato grado di sovrasaturazione. La fase cruciale del processo di condensazione è rappresentata dalla formazione di goccioline di dimensioni tali da permettere un’ulteriore rapida condensazione del vapore su di esse, cioè di dimensioni ³
, per cui, in base all’equazione di Kelvin, esse dovrebbero vaporizzare, pervenendosi così all’assurdo che il gas non può condensare. In realtà, si avrà condensazione sulle pareti del recipiente o su particelle di polvere eventualmente presenti, mentre, in sistemi molto puri si può raggiungere un elevato grado di sovrasaturazione. La fase cruciale del processo di condensazione è rappresentata dalla formazione di goccioline di dimensioni tali da permettere un’ulteriore rapida condensazione del vapore su di esse, cioè di dimensioni ³![]() . Queste goccioline vengono chiamate nuclei e la loro formazione processo di nucleazione. Come visto, per ogni valore di P, ad una data T, esiste una grandezza critica al di sopra della quale l’energia libera diminuisce per accrescimento della goccia.
. Queste goccioline vengono chiamate nuclei e la loro formazione processo di nucleazione. Come visto, per ogni valore di P, ad una data T, esiste una grandezza critica al di sopra della quale l’energia libera diminuisce per accrescimento della goccia.
Fonte: https://www.docenti.unina.it/downloadPub.do?tipoFile=md&id=61398
Sito web da visitare: https://www.docenti.unina.it
Autore del testo: indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve