I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
appunti sulla Corrosione e Protezione dei materiali.
Premessa.
Queste dispense sulla Corrosione e Protezione dei Materiali sono state preparate per il corso di aggiornamento tecnico svolto. Si spiegano in modo semplice i concetti alla base dei fenomeni corrosivi e si descrivono le tecniche comunemente impiegate per la protezione dei materiali in ambienti naturali e industriali. Le dispense possono solo costituire un primo scritto di riferimento, rimandando a testi citati in bibliografia per eventuali approfondimenti.
E’ importante osservare che per affrontare i problemi di tipo corrosionistico è necessario alcune basilari conoscenze di metallurgia e di chimica e, cosa affatto secondaria, un buon bagaglio di esperienza accumulato nel tempo. I fattori che possono influenzare il comportamento di un materiale in un certo ambiente sono infatti numerosi e spesso interagenti in modo non immediato. Individuare origine e cause scatenanti un danneggiamento corrosivo può essere affatto semplice, così come individuare la migliore soluzione tecnico-economica al problema. Ciò che aiuta è avere chiari i principi di base della corrosione e, prima di giungere a conclusioni affrettate, raccogliere tutti i dati e le informazioni sull’impianto e sulla sua ‘storia’ operativa, e condurre tutte le analisi richieste per una chiara caratterizzazione del tipo di danneggiamento, tipo di ambiente, tipo di materiale e specifiche caratteristiche di lavoro dell’accoppiamento materiale-ambiente. Pertanto, come parte integrante del corso, si conducono esercitazioni pratiche di laboratorio per studiare, analizzare e risolvere alcuni casi di danneggiamenti realmente occorsi in impianti industriali e non, in modo da proporre una metodologia sistematica e razionale da seguire nell’analisi dei casi di corrosione.
Il fine del corso non è certo quello di formare dei professionisti della corrosione e protezione dei materiali, ma di trasmettere la cultura e la sensibilità sui fenomeni corrosivi, requisito di grande utilità per operare in una qualsiasi realtà industriale.
Con il termine corrosione si indica il complesso dei fenomeni chimico-fisici che comportano il degrado dei materiali metallici ad opera dell'ambiente a cui sono esposti. La corrosione è un lento attacco chimico promosso dall'affinità chimica tra il metallo o lega ed alcuni componenti dell'ambiente (O2, acidi, ecc.). Si parla in tal senso di ANTIMETALLURGIA, poiché il metallo torna alle forme termodinamicamente più stabili, dalle quali era stato sottratto mediante somministrazione di lavoro elettrico o chimico (estrazione, raffinazione).
La maggior parte dei materiali metallici di impiego industriale è di fatto TD-nte instabile in ambiente naturale. La spontaneità (e quindi irreversibilità) di una reazione dallo stato metallico allo stato ossidato Me° = Mez+ + z e- è quantificata dalla diminuzione di Energia Libera (di Gibbs) associata alla reazione. Se una reazione chimica ha associato un DG <0, vuol dire che la reazione è favorita TD-nte e si svolge irreversibilmente nel verso in cui è scritta. Quando il DG per la reazione ha segno positivo, vuol dire che la reazione non avviene nel verso in cui è scritta ma è spontanea nel verso opposto. Il DG di una reazione ad una data temperatura e con certe concentrazioni (attività) delle specie coinvolte si può calcolare da dati termodinamici tabulati.
Gli ambienti naturali sono in genere caratterizzati dalla presenza di ossigeno e nell’acqua sono sempre presenti ioni H+ che possono, in linea di principio, ossidare molti metalli. Nella Tabella 1 si riportano i valori di DG relativi alle reazioni di ossidazione di alcuni metalli con quest’ultime specie. Si osserva come K, Zn e Fe abbiano tutti DG negativi in corrispondenza di entrambe le reazioni, mentre il rame metallico può passare alla forma ossidata solo se presente ossigeno. Infine l’oro metallico non viene ossidato spontaneamente né dall’ossigeno né dall’ambiente acido.
Reazione DG = DH - TDS (KCal/mol.) |
|||
|
Evoluzione H2, (pH = 0) |
Assorbimento O2 (pH =7) |
|
K <-> K+ |
-67.4 |
-86.2 |
|
Zn <-> Zn++ |
-17.9 |
-36.7 |
|
H <-> H+ |
0.0 |
-18.8 |
|
Fe <-> Fe++ |
-11.6 |
-30.4 |
Fe, Zn -> metalli attivi |
Cu <-> Cu++ |
7.8 |
-11.02 |
Cu, Ag -> metalli seminobili |
Au <-> Au++ |
34.5 |
15.7 |
Au, Pt, Pd -> metalli nobili |
Tabella 1.
Da questi dati si può capire come mai non possono esistere miniere di ferro o zinco metallico, presenti normalmente sotto forma di ossidi/minerali. Esistono invece filoni di oro e platino metallici.
I materiali di uso ingegneristico, quando esposti in atmosfere naturali o industriali, tendono quindi ad ossidarsi, cioé corrodersi. Quando ciò accade si dice che il materiale è in condizioni di attività. Tuttavia, la condizione termodinamica non è la sola a dover essere considerata. Ha infatti enorme interesse sapere anche a quale velocità procederà il danneggiamento, cioè quale sarà la cinetica dei processi corrosivi.
I danni causati dalla corrosione sono enormi. Il danneggiamento corrosivo spesso non si limita alla semplice sostituzione del componente interessato (costi diretti), ma possono comprendere una serie di danni indiretti, quali ad es. perdite di prodotto attraverso condutture o apparecchiature, fermi impianto non programmati, incidenti agli operatori ecc. Un caso frequente è la perdita di prodotto conseguente alla foratura di un'apparecchiatura di scambio termico; il prodotto entra così nel circuito di raffreddamento e viene scaricato all'esterno con scarse probabilità di individuazione. Danni indiretti sono anche la perdita di efficienza di apparecchiature in conseguenza ad accumuli di prodotti di corrosione; questi fanno aumentare le perdite di carico ed obbligano ad accrescere la potenza di pompaggio, o diminuiscono i rendimenti degli scambi termici modificando i bilanci energetici, le temperature di processo, la qualità e la resa in prodotto finito. Danni indiretti sono da considerare quelli provocati dall'inquinamento dei prodotti (industria alimentare e farmaceutica) e dai conseguenti fermi impianto per permettere la sostituzione delle apparecchiature deteriorate.
Il problema della corrosione deve essere affrontato già in sede di progettazione delle apparecchiature, predisponendo un'oculata scelta dei materiali ed un'efficace sistema di protezione; deve essere inoltre previsto un adeguato sistema di conduzione e manutenzione dell'impianto durante la sua vita operativa seguendo il principio generale di ottenere un grado di affidabilità per i singoli componenti tanto maggiore quanto più vitale è il ruolo da essi ricoperto.
Esistono due tipi di corrosione: a) corrosione a secco, cioè ossidazione dei metalli ad alta temperatura con cinetiche dipendenti dalla Termodinamica Chimica, b) corrosione ad umido, cioè corrosione in ambiente acquoso attraverso processi di natura elettrochimica dipendenti dalla termodinamica e cinetica elettrochimica. Nella corrosione a umido l'ambiente corrosivo è costituito da soluzioni acquose, con funzionamento di sistemi galvanici in cui il processo corrosivo è la risultante di un processo anodico di dissoluzione del materiale in congiunzione a un parallelo processo catodico. Queste semireazioni avvengono entrambe in stretta prossimità della superficie metallica.
Consideriamo, ad esempio, il processo di corrosione di un metallo immerso in acqua contenente ossigeno disciolto.
Il processo corrosivo può essere suddiviso in due processi indipendenti, concomitanti e complementari:
1) processo anodico (ossidazione). Trasferimento del metallo in ioni idratati, con un numero equivalente di elettroni "lasciati" sulla superficie del metallo. Me -> Me++(nH2O) + 2e-
2) processo catodico (riduzione). Assimilazione dell'eccesso di elettroni da parte di depolarizzatori (atomi, molecole o ioni capaci di essere ridotti al catodo), in questo esempio ossigeno, tramite la semireazione O2 + 2e- + H2O -> 2OH-
Questi due processi sono indipendenti ma complementari, nel senso che il numero di elettroni nell’unità di tempo lasciati sulla superficie metallica dalla reazione anodica deve essere uguale al numero di elettroni nell’unità di tempo consumati dal depolarizzatore nella semireazione catodica [ vox = vred]. Infatti, se così non fosse, si avrebbe un accumulo di carica elettrica nel metallo.
Queste relazioni avvengono entrambe all’interfaccia metallo-soluzione acquosa, zona nella quale esse possono comportare modificazioni sensibili dell'ambiente acquoso (ad esempio un sensibile aumento di pH). Le reazioni secondarie che avvengono quando i prodotti delle reazioni anodiche e catodiche vengono a contatto fra loro o con altre sostanze ambientali, portano alla separazione di ossidi, idrossidi, sali basici. In funzione delle caratteristiche chimico-fisiche e costitutive degli eventuali strati superficiali formati (continuità, compattezza, conducibilità elettronica, ecc. ecc.) si possono avere sensibili riflessi sulla velocità con cui proseguono nel tempo i processi corrosivi.
Ad esempio, nel caso del ferro in ambiente acquoso a pH = 7 (acqua naturale).
Reazione anodica |
Fe à Fe+++ 2e- |
Reazione catodica |
0.5 O2 + 2e- + H2O à 2OH- |
In soluzione |
Fe++ + 2OH-à Fe(OH)2 |
Reazione globale di corrosione ad umido |
Fe + 0.5 O2 + H2O à Fe(OH)2 |
A causa dell'ambiente esterno l'idrossido ferroso può a sua volta essere ossidato a idrossido ferrico (ma anche direttamente Fe2+àFe3+):
2 Fe(OH)2 + 0.5 O2 à Fe2 O3 . H2O + H2O (Fe2O3 ematite)
Viene così a formarsi la ben nota ruggine di colore rosso-bruno. Tuttavia, in funzione delle caratteristiche ambientali, sono possibili diversi stati di ossidazione del ferro. Di solito, la ruggine spessa è formata da strati successivi di FeO (Wustite), Fe3O4 .H2O (Magnetite idrata verde), Fe3 O4 (Magnetite Anidra Nera), Fe2O3 .H2O (Ematite rosso-bruna). Il deposito di ruggine è per sua natura discontinuo, poroso e scarsamente protettivo. Sebbene la sua presenza rallenti in qualche misura la velocità di corrosione del metallo sottostante, il danneggiamento prosegue comunque a velocità apprezzabili e dipendenti dall’ambiente corrosivo.
Vi sono anche strati superficiali di prodotti di corrosione abbastanza protettivi, come nel caso dello zinco esposto all'azione atmosferica, dove vengono a formarsi miscugli di ossidi/idrossidi di zinco e vari altri sali basici, capaci di proteggere almeno parzialmente il metallo sottostante; oppure strati spessi e compatti di solfato di ferro per acciai in contatto con acido solforico concentrato.
Nel caso in cui l’interazione tra metallo e ambiente comporti la formazione di composti assai protettivi, capaci cioè di ridurre in modo drastico la velocità di corrosione, si parla di stato di passività del metallo (ad esempio acciai inox, titanio, superleghe base nichel, alluminio in ambienti naturali ).
Il fatto che la corrosione in ambiente umido proceda attraverso un meccanismo di tipo elettrochimico implica che sulla superficie metallica procedano entrambe le semireazioni di ossidazione del metallo e di riduzione di una più delle specie presenti nell’ambiente aggressivo. Molto spesso è possibile distinguere anche visivamente dove siano localizzate le diverse aree elettrodiche. Cioè è possibile identificare quali siano le regioni della superficie metallica dove si sono svolgono le reazioni di riduzione (regioni catodiche) e quelle dove si svolgono le reazioni anodiche (ossidazione del metallo). Un esempio classico è quello della goccia d’acqua depositata sulla superficie di un acciaio, vedi Fig.2.1, o quello di una sbarra affondata parzialmente nel fondale marino. In questo caso, come in altri che verranno illustrati ad esempio, si parla di corrosione per areazione differenziale.
Nell’esempio della goccia d’acqua, il processo di corrosione avviene inizialmente sull’intera superficie metallica bagnata, processo promossa dalla presenza di ossigeno disciolto nell’acqua. La reazione anodica è la dissoluzione del metallo, mentre la reazione catodica è la riduzione dell’ossigeno a dare ioni OH-. Il procedere della corrosione determina un impoverimento di ossigeno all’interno della goccia, ossigeno che può essere reintegrato solo per reintegro dall’atmosfera esterna. Tuttavia, questo reintegro avviene con relativa facilità solo nelle regioni più esterne della goccia, e la lenta diffusione dell’ossigeno nell’acqua determina l’instaurarsi di un gradiente di concentrazione di O2 con la regione centrale della goccia. La superficie del metallo più prossima alla superficie esterna diventano così catodiche rispetto a quella centrale. La regione anodica, dove cioè passa in soluzione il metallo (corrosione), si localizza nella regione centrale della goccia.
Si supponga adeso di avere tre vaschette contenenti soluzioni acquose a pH=0 di acido cloridrico (HCl), Fig.2.2. Nella prima vaschetta si immerge una sbarretta di zinco commerciale, nella seconda si immergono due sbarrette di zinco e di ferro saldate tra loro e nella terza una sbarretta di zinco purissimo. Una netta separazione tra regioni a prevalente funzionamento catodico e anodico si può osservare nelle prime due vaschette, mentre nella terza questa separazione non è affatto evidente. Nei primi due casi si osserva lo sviluppo di bollicine di idrogeno gassoso dalla reazione catodica 2H+ + 2e- = H2, che avviene sulle impurezze di ferro presenti nello zinco commerciale nel primo caso e sulla barretta di ferro nel secondo. Tutte le altre aree sono evidentemente sede della reazione anodica di ossidazione dello zinco secondo la reazione Zn = Zn++ + 2e-.
Nella Teoria delle coppie locali la natura elettrochimica del processo corrosivo è accertabile visivamente, come in questi primi due casi. Appare intuitivo schematizzare il sistema corrosivo raggruppando tutte le aree catodiche in un unico elettrodo con superficie corrispondente e tutte le aree anodiche in un unico elettrodo con superficie corrispondente. Il sistema corrosivo può essere così schematizzato come una cella galvanica bielettrodica cortocircuitata, vedi Fig.2.3.
Nella terza vaschetta non si distinguono con chiarezza dove siano le aree catodiche/anodiche, poiché la superficie della barretta di zinco non presenta alcuna eterogeneità che possa favorire la localizzazione delle reazioni elettrodiche. Si suppone in tal caso che una stessa porzione di superficie possa funzionare da area catodica e da area anodica in un susseguirsi statistico nel tempo. La natura elettrochimica della corrosione si deduce dal fatto che i fattori influenzanti il processo risultante (temperatura, concentrazione delle specie ecc.) agiscono in modo del tutto analogo ai casi precedenti. Questa teoria suppone la sovrapponibilità delle curve anodiche e catodiche, concetto che verrà ripreso nel seguito.
Nota: Da un punto di vista elettrochimico il catodo è sempre l'elettrodo sul quale avvengono fenomeni di riduzione.Da un punto di vista elettrico il catodo è sempre l'elettrodo entro cui fluisce corrente proveniente dal conduttore elettrolitico.
Il catodo è l’elettrodo positivo (+) quando il sistema galvanico funge da generatore, è l’elettrodo negativo (-) quando il sistema assorbe energia (elettrolisi).
Un processo corrosivo ha luogo quando sono verificati determinati presupposti termodinamici e cinetici. Come prima detto, la reazione tra un metallo M e l'ambiente:
M + 1/2 O2 + H2O = M(OH)2 [1]
è termodinamicamente possibile solo se accompagnata da una diminuzione dell'energia libera DG del sistema, variazione che esprime inoltre il lavoro motore disponibile per il processo stesso. Questa condizione è verificata nel caso del ferro puro nell'atmosfera, vedi Tabella 1: in questo caso si parla di stato di ATTIVITA'. Quando la reazione -1- non è termodinamicamente possibile (DG > 0), il materiale si dice in stato di IMMUNITA' (ad es. oro in atmosfera). Vi sono però casi in cui la reazione è T.D. possibile, ma estremamente lenta dal punto di vista cinetico e si parla allora di stato di PASSIVITA' (è il caso del Cr e degli acciai INOX che si ricoprono di un film protettivo di ossido di cromo).
La reazione generica (1) è di natura elettrochimica ed è, come prima visto, il risultato di due reazioni concorrenti, di cui una catodica che porta alla riduzione delle specie accettrici di elettroni (dall'ambiente) e una anodica di dissoluzione delle specie donatrici di elettroni (il metallo).
Per comodità si farà riferimento allo schema della cella galvanica bielettrodica cortocircuitata. Considerando le condizioni di circuito aperto della cella galvanica, senza cioè che fluisca corrente, si ha che:
DG = -zF(f.e.m.) = -zF( Ecateq – Eaneq)
dove: Ecateq / Eaneq sono i potenziali elettrodici di equilibrio, calcolabili mediante l'equazione di Nerst, z = numero di elettroni scambiati, F = costante di Faraday, T = temperatura assoluta in Kelvin.
Per una generica reazione redox : aA + bB = cC +dD +ze- l’Equazione di Nerst si scrive:
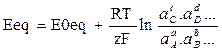
Dove E0eq = potenziale redox standard (specie coinvolte ad attività unitaria, a T=25°C, Patm, potenziale riferito all’elettrodo standard di di idrogeno)
Si può quindi esprimere la condizione termodinamica affinché la reazione di corrosione possa avvenire:
DG <0 à Ecateq > Eaneq La reazione di corrosione può avvenire, ma bisogna aggiungere
indicazioni sulla velocità del processo.
DG =0 à Ecateq = Eaneq Reazione in condizioni di equilibrio
DG >0 à Ecateq < Eaneq La reazione di corrosione non può avvenire. Il metallo è in stato
di immunità.
Le reazioni anodiche che ci interessano sono quelle di dissoluzione dei metalli. Facendo riferimento alla scala dei potenziali standard (25 °C, concentrazione di tutte le specie presenti 1 M, pressione delle specie gassose 1 atm) rispetto all’elettrodo standard di idrogeno (SHE), si può calcolare, ad esempio, il potenziale del ferro in equilibrio con una soluzione acquosa con concentrazione di ioni ferrosi 10-3M (coppia redox Fe++/Fe):
Fe à Fe+++ 2e- reazione anodica
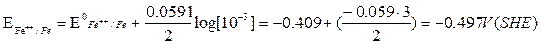
Le reazioni catodiche di maggior interesse sono quelle possibili in ambienti naturali (P= 1 atm):
1- Riduzione di O2 à O2 + 4H+ + 4e- à 2H2O 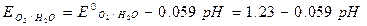
2 - Riduzione di H+ a dare H2h à 2H+ + 2e- à H2h
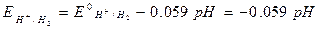
Nelle soluzioni acquose possono poi esserci altre coppie redox. Ad esempio:
NO2- + 2H+ + e- à NO + H2O
Fe3+ + e- = Fe2+
Cr6+ + 3e- = Cr3+
Pertanto, dalla conoscenza del potenziale elettrodico del metallo nell’ambiente aggressivo d’interesse è possibile dedurre se il metallo è TD-nte o meno aggredibile per corrosione. Basta calcolare il potenziale di equilibrio del metallo (se non sono inizialmente presenti di ioni del metallo si può fare riferimento ad una concentrazione pari a 10-6 M), calcolare il potenziale delle possibili reazioni catodiche presenti in quell’ambiente, e verificare se almeno una di queste è superiore in valore al potenziale di equilibrio del metallo. Se questo accade, allora la reazione di corrosione avviene ed è spontanea. Altrimenti, il metallo è in quell’ambiente in condizioni di immunità termodinamica e non si corrode.
Potenziali standard dei semi-elementi (25°C) riferiti all'elettrodo standard di idrogeno (SHE)
Si può verificare che:
1) le soluzioni acide disareate possono corrodere tutti i metalli a partire del Pb. (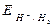 a pH = 0 à 0 V (SHE))
a pH = 0 à 0 V (SHE))
2) le soluzioni neutre disareate possono corrodere il Fe e tutti i metalli meno nobili.(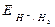 a pH =7à-0.414 V (SHE))
a pH =7à-0.414 V (SHE))
3) Le soluzioni acide areate possono corrodere anche metalli seminobili come l'Ag. 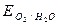 a pH= 0 à +1.23 V (SHE))
a pH= 0 à +1.23 V (SHE))
4) Le soluzioni contenenti cloro e fluoro possono corrodere tutti i metalli usuali.
I diagrammi di Pourbaix di un materiale metallico immerso in un ambiente corrosivo acquoso mostrano, in funzione del potenziale del metallo e del pH dell’ambiente, quali sono i campi di stabilità del metallo, dei suoi ioni, ossidi, idrossidi o altri possibili composti. Nella Fig.2. 4 si mostra il diagramma di Pourbaix del ferro in acqua. I campi di stabilità delle varie specie esprimono la stabilità termodinamica di quella specie per certe possibili combinazioni E-pH. Questo vuol dire che se il metallo è portato a lavorare nel campo di stabilità del suo ione Fe2+o dello ione Fe3+, questo si corroderà perché in tali condizioni è stabile lo ione ossidato del metallo (condizioni di ATTIVITA’). Se il metallo è portato a lavorare nel campo di stabilità del ferro metallico, quest’ultima sarà la forma stabile e, pertanto, il metallo non si corroderà (condizioni di IMMUNITA’). Infine, se il metallo è portato a lavorare in condizioni di potenziale e pH ambientale dove è stabile un ossido, per esempio Fe3O4, sulla superficie metallica si formerà quest’ultimo, in linea di massima capace di proteggere almeno parzialmente il metallo sottostante (condizioni di passività). Nel diagramma sono anche riportate due rette (a, b) a differenti altezze e di pari inclinazione (incl.= -0,059). Queste rette sono relative alla variazione del potenziale redox della riduzione di idrogeno (retta a) e di ossigeno (retta b) al variare del pH della soluzione acquosa. Pertanto, la condizione di corrodibilità del metallo in un ambiente naturale che contenga solo H+ (deareato) o anche O2 (ossigenato) può essere immediatamente deducibile.
Si riportano nel seguito i diagrammi di Pourbaix relativi ad altri metalli, v.Fig.2.5. Si può ad esempio osservare che il rame non è corrodibile da una soluzione acquosa deareata, anche se a pH=0, mentre è corrodibile in presenza di ossigeno. Si osserva inoltre come per il cromo, metallo decisamente poco nobile, si estenda notevolmente il campo di stabilità dell’ossido, cioè si verificano per ampi intervalli di pH e potenziale condizioni di possibile passività.
Limitazione dei diagrammi E-pH.
Le condizioni di equilibrio termodinamico di un metallo immerso in una soluzione contenente suoi ioni non sono statiche ma dinamiche: si svolge in continuazione una reazione di ossidazione del metallo a dare ioni ed una reazione di riduzione da ioni ad atomi metallici, reazioni che avvengono però alla stessa velocità. Si ha cioé un equilibrio dinamico in condizioni di reversibilità per cui ian = icat = i0 , dove i0 si definisce densità di corrente di scambio. In queste condizioni di equilibrio (DG =0) non si ha corrosione del metallo, poiché non vi è un flusso netto di metallo verso la soluzione acquosa. Il Potenziale Reversibile di Equilibrio è calcolabile, come prima visto, mediante l'equazione di Nerst:
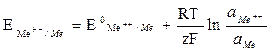
All'equilibrio metallo-soluzione, il potenziale assunto dal metallo è proprio il potenziale 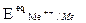 calcolato con Nerst.
calcolato con Nerst.
Se a questo punto si impone al metallo un potenziale più elevato del suo potenziale di equilibrio 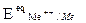 ha , il bilanciamento iniziale tra la velocità di ossidazione del metallo e quella di riduzione degli ioni metallici non sarà più rispettato. In particolare, se ci spostiamo con la sovratensione verso valori maggiori di potenziale si favorisce la reazione in senso anodico e si deprime la velocità di riduzione in senso catodico. Si instaura in tal modo un flusso netto di metallo che passa allo stato ossidato in soluzione come ione. Il metallo quindi si consuma, avviene cioè il processo corrosivo del metallo. La sovratensione ha > 0 possiamo imporla dall’esterno collegando il metallo a un alimentatore a corrente continua, oppure la può imporre una reazione redox presente nell’ambiente corrosivo, a patto che abbia un potenziale redox più alto di quello di equilibrio termodinamico del metallo (Ecat –Ean > 0, quindi DG<0).
ha , il bilanciamento iniziale tra la velocità di ossidazione del metallo e quella di riduzione degli ioni metallici non sarà più rispettato. In particolare, se ci spostiamo con la sovratensione verso valori maggiori di potenziale si favorisce la reazione in senso anodico e si deprime la velocità di riduzione in senso catodico. Si instaura in tal modo un flusso netto di metallo che passa allo stato ossidato in soluzione come ione. Il metallo quindi si consuma, avviene cioè il processo corrosivo del metallo. La sovratensione ha > 0 possiamo imporla dall’esterno collegando il metallo a un alimentatore a corrente continua, oppure la può imporre una reazione redox presente nell’ambiente corrosivo, a patto che abbia un potenziale redox più alto di quello di equilibrio termodinamico del metallo (Ecat –Ean > 0, quindi DG<0).
Quindi condizione necessaria affinché un metallo si corroda in un ambiente acquoso è che il suo potenziale sia portato ad un valore più elettropositivo (più nobile) del suo potenziale di equilibrio termodinamico in quell’ambiente.
Dato che le correnti elettrodiche corrispondono in pratica a flussi di materia, e la corrente di ossidazione corrisponde alla dissoluzione anodica del metallo, è molto importante sapere come variano tali le correnti in funzione delle sovratensioni imposte al metallo. Tali relazioni devono esprimere, in sostanza, l’entità delle dissipazioni energetiche che si accompagnano al procedere delle reazioni elettrodiche. Un primo e importante fattore di dissipazione è legato al processo di trasferimento di carica (acquisto o perdita di elettroni), che avviene tra le specie coinvolte a ridosso della superficie metallica. Si può dimostrare che quando l’entità delle sovratensioni anodiche/catodiche è superiore a 50 mV in valore assoluto, la relazione tra sovratensione e corrente è di tipo logaritmico. In questo caso valgono le equazioni di TAFEL:
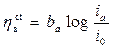 per ha > 50 mV
per ha > 50 mV
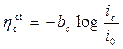 per hc < - 50 mV
per hc < - 50 mV
Si dimostra, parimenti, che nei dintorni del potenziale di equilibrio, cioè per sovratensioni minori in valore assoluto di 30 mV, la relazione tra sovratensione e corrente è di tipo lineare:
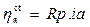
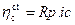
dove, Rp= Resistenza di polarizzazione, ia/ic= densità di corrente anodica/catodica.
In un diagramma lineare potenziale-corrente l’andamento complessivo è rappresentato in Fig.2.6. In corrispondenza del potenziale di equilibrio 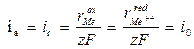 e nei suoi dintorni la relazione h-i è di tipo lineare. Abbastanza lontani dal potenziale di equilibrio (h > 50 mV) la relazione h-i diventa logaritmica (quindi in un diagramma E-i la relazione è rappresentata da una curva). Il ramo con sovratensioni positive (ha) è il ramo di polarizzazione anodica rispetto al potenziale di equilibrio, mentre il ramo con sovratensione negativa (hc) è il ramo di polarizzazione catodica.
e nei suoi dintorni la relazione h-i è di tipo lineare. Abbastanza lontani dal potenziale di equilibrio (h > 50 mV) la relazione h-i diventa logaritmica (quindi in un diagramma E-i la relazione è rappresentata da una curva). Il ramo con sovratensioni positive (ha) è il ramo di polarizzazione anodica rispetto al potenziale di equilibrio, mentre il ramo con sovratensione negativa (hc) è il ramo di polarizzazione catodica.
Se si utilizza un diagramma semi logaritmico E – log i e riportando in ascissa il valore assoluto della corrente (in modo da avere entrambi i rami della curva di polarizzazione nello stesso quadrante), otterremo nei dintorni del potenziale di equilibrio un andamento non lineare e per ha , |hc | > 50 mV un andamento lineare. Per metalli bivalenti come ad esempio il Fe, si ha che la corrente varia di un fattore 10 per ogni 60 mV di sovratensione. Nel caso si resistenza per trasferimento di carica, le correnti elettrodiche e quindi la cinetica dei processi elettrodici è descritta dai parametri ba/bc (coeficienti di Tafel) e i0.(densità di corr. di scambio del metallo)
Questa situazione si verifica per tutti gli equilibri delle coppie redox presenti, sia per il metallo sia per le possibili reazioni catodiche che avvengono sulla superficie del metallo, come la riduzione di H+ e/o la riduzione di O2 negli ambienti naturali.
I valori delle costanti cinetiche ba, bc, i0 per vari equilibri sono tabulati in Tabella 2.1. Si può osservare come le variabili cinetiche possono variare entro larghi intervalli numerici. Come dato di fatto, nella cinetica dei processi elettronici sono significative molte variabili, come ad esempio lo stato delle superfici metalliche dove vanno a stabilirsi gli equilibri.
In un sistema elettrochimico di corrosione si hanno reazioni in cui la corrente (elettroni) passa da una specie chimica ad un’altra del tutto differente (ad esempio dal ferro all’H+) e questo non può essere un processo di equilibrio.
Si supponga infatti di avere ferro che si corrode in ambiente acido grazie alla riduzione di ioni H+. In questo caso la perdita di elettroni all'elettrodo avviene (principalmente) tramite il processo di ossidazione del metallo, mentre l'acquisto degli stessi avviene (principalmente) mediante il processo concomitante di riduzione di H+. Entrambi i processi avvengono sulla superficie del metallo, ed ognuno avrà un suo potenziale di equilibrio calcolabile con Nerst. In questo caso, è come se all'originale equilibrio del metallo immerso in una soluzione contenente suoi ioni, andassimo a sovrapporre una seconda reazione redox 2H+ + 2e- = H2 che ha un suo potenziale di equilibrio, supposto nell’esempio maggiore (più elettropositivo). Il metallo però può assumere un solo valore di potenziale e non due potenziali diversi. Andrà quindi a stabilizzarsi ad un valore di potenziale intermedio tra i due, potenziale che per sua natura è un potenziale misto e che chiameremo potenziale di corrosione libera del metallo Ecorr). La differenza in valore tra questo potenziale misto e l’originale potenziale di equilibrio della reazione anodica del metallo costituisce la sovratensione anodica (ha = Ecorr - Eeq. Fe++/Fe ), e la differenza tra questo potenziale e il potenziale di equilibrio della reazione catodica costituisce la sovratensione catodica (hc = Eeq. Me++/Me - Ecorr). Il potenziale misto Ecorr si stabilizzerà laddove tutta la forza motrice disponibile (f.e.m.= Ecat – Ean) viene dissipata per far avanzare le reazioni elettroniche e per vincere l’eventuale caduta ohmica attraverso la soluzione. Naturalmente, è indispensabile che si realizzi a tale potenziale un bilancio tra le cariche elettriche provenienti dalle semireazioni anodiche e quelle assorbite dalle reazioni catodiche (iox=ired).
Tuttavia, in questo caso non si realizza più un bilancio di massa sullo ione metallico, in quanto il processo anodico interessa quasi esclusivamente il metallo (che si corrode), mentre quello catodico interessa quasi esclusivamente l’altra specie coinvolta (H+). Il flusso netto di metallo che passa in soluzione costituisce quindi la corrente anodica e quindi la velocità di corrosione iox= icorr, corrente che si ottiene in corrispondenza del potenziale potenziale di corrosione, Ecorr.
Vediamo quindi come operano le due coppie redox indipendentemente tra loro e come si accoppiano a definire le condizioni stazionarie del processo corrosivo del metallo .
PRIMO EQUILIBRIO EquilibrioT.D. 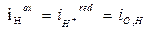
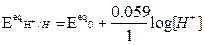
SECONDO EQUILIBRIO Equilibrio T.D. 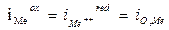
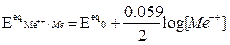
Se accoppiamo queste due reazioni redox sulla superficie del metallo e supponiamo che 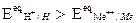 , si avrà che:
, si avrà che:
Supponendo di operare in soluzione acquosa con conducibilità del mezzo corrosivo molto grande ( RI=0), le condizioni stazionarie di funzionamento si avranno quando tutta la forza motrice disponibile (Ecat – Ean) sarà dissipata nella somma della sovratensione anodica e sovratensione catodica, cioè quando ha + /hc/ = Ecat - Ean (più in generale sarà ha + /hc/ + RI = Ecat - Ean).
Si individuano in tal modo le condizioni stazionarie di funzionamento del sistema corrosivo nel punto di intersezione tra le curve di polarizzazione delle due coppie redox, condizioni che determinano: Ecorr= Potenziale libero di corrosione del metallo (V), icorr = velocità di corrosione ( A/m2)
Il valore del potenziale di corrosione non è calcolabile da dati termodinamici essendo ,come prima detto, associato ad una reazione irreversibile, ma dipenderà essenzialmente da fattori cinetici (valori di i0 e sovratensioni elettroniche ha /hc) legati allo svolgimento dei processi elettronici. Si può dire che le condizioni stazionarie di lavoro del sistema corrosivo si raggiungeranno quando l’intero LAVORO MOTORE disponibile (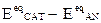 ) andrà dissipato negli ATTRITI del sistema causati dal passaggio di corrente.
) andrà dissipato negli ATTRITI del sistema causati dal passaggio di corrente.
Cioè: allo stazionario: 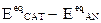 = ha + |hc | +RI (con RI caduta ohmica)
= ha + |hc | +RI (con RI caduta ohmica)
NOTA. Nella maggior parte dei casi di corrosione in ambiente acquoso, si tratta di soluzioni ad alta conducibilità ionica e con distanze tra regioni anodiche/catodiche molto ridotte. Pertanto il termine di caduta ohmica RI può essere di norma trascurato e le condizioni di lavoro del sistema corrosivo (Ecorr/Icorr) possono determinarsi dalla intersezione delle curve anodiche e catodiche. Riassumendo:
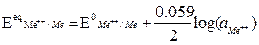 EANh
EANh
la polarizzazione impone
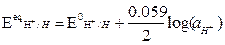 ECATi
ECATi
Si è detto che nei processi corrosivi in ambiente acquoso si ha generalmente, come processo catodico, lo sviluppo di H2 e/o la riduzione di O2 disciolto. Analizziamo più in dettaglio le relative sovratensioni elettroniche.
Sovratensione catodica per trasferimento di carica.
H3O+ + e- à Hads + H2O
2 Hads à H2
n H2 à n H2h
si osserva un’anticorrelazione con la
sovratensione del metallo con i propri ioni, cioè tanto maggiore è l’ i0,Me quanto minore è l’ i0,H2 su quel metallo.
Il coefficiente di TAFEL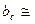 0,13 / 0,15 (V/decade)
0,13 / 0,15 (V/decade)
Le sovratensioni per trasferimento 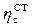 ). La resistenza diventa praticamente infinita in corrispondenza di un valore di corrente anodica detta corrente limite
). La resistenza diventa praticamente infinita in corrispondenza di un valore di corrente anodica detta corrente limite
iL 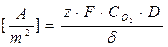
Dove, Co2 = concentrazione O2 nell’ambiente acquoso, D = coefficiente di diffusione O2 nel mezzo acquoso, d = spessore strato limite di Nerst
Per lo studio di un sistema corrosivo tramite le curve di polarizzazione anodica e catodica, sono importanti le implicazioni derivanti dalla teoria delle tensioni miste. Come detto in precedenza, anche in assenza di evidenti eterogeneità superficiali (base della teoria delle coppie locali) tale teoria ammette la possibilità che su di una stessa porzione di superficie di un materiale perfettamente omogeneo immerso in una soluzione omogenea, si svolgano contemporaneamente due o più processi elettronici, alcuni in un senso ed altri in senso opposto (anodico/catodico) in un susseguirsi statistico di posizioni sulla superficie e rispetto al tempo. Tale teoria implica la sovrapponibilità delle curve parziali di polarizzazione.
Le assunzioni sono:
Pertanto un qualsiasi sistema corrosivo, anche costituito da più reazioni anodiche e catodiche, le condizioni stazionarie di funzionamento si stabilizzeranno al potenziale Ecorr per cui risulta: 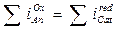
A titolo d’esempio, si può considerare qualitativamente il caso di una sbarretta di ferro immersa in acqua areata a pH = 7. Il potenziale di corrosione libera del metallo Ecorr sarà quel potenziale per cui 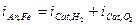 (avendo considerato trascurabili le cadute ohmiche attraverso il conduttore elettrolitico)
(avendo considerato trascurabili le cadute ohmiche attraverso il conduttore elettrolitico)
Si intende per passivazione la perdita di reattività del materiale sotto certe condizioni ambientali. La passività è quindi uno stato di bassa velocità di corrosione e cioé di scarsa reattività del materiale metallico con l’ambiente aggressivo. Tale stato è in genere associato alla formazione di un film solido interfacciale, in genere un ossido, molto protettivo e capace di rallentare drasticamente l’attacco corrosivo del metallo sottostante. Gli stati superficiali protettivi possono essere costituiti da uno strato monoatomico di O2 adsorbito, o da ossidi, idrossidi, prodotti di corrosione o sali precipitati dalla soluzione acquosa quando si raggiungono le condizioni favorevoli: per gli ossidi Ecorr > EM/M0 dell’ossido e per i sali il superamento dei rispettivi prodotti di solubilità (AgCl, PbSO4, FeSO4, CaCO3 ecc..). Questi strati o film superficiali costituiscono una barriera tra il metallo e l’ambiente circostante. Non sempre gli strati superficiali che si formano sulla superficie dei metalli sono protettivi, dipendendo tale proprietà dalla compattezza, porosità, conducibilità ionica ed elettronica del deposito. Da un punto di vista ingegneristico il fenomeno è molto importante, e rende conto dell’elevata resistenza alla corrosione di molti metalli e leghe intrinsecamente poco nobili, come Al, Cr, Ti, Ta, e anche acciai inox, superleghe, rame e le sue leghe in acqua di mare, acciaio al carbonio in H2SO4 diluito ecc…
I tipici metalli che esibiscono il fenomeno della passività sono:
Fe, Cr, Ni, Ti, Al e loro leghe.
La curva di polarizzazione anodica di un materiale con comportamento attivo-passivo ha la caratteristica forma a S di Fig. 2.8. AIl materiale ha un comportamento attivo (curva definita dai parametri cinetici io e ba) a partire dal suo potenziale di equilibrio fino ad un certo potenziale Epp , detto ‘potenziale di passività primaria’, in corrispondenza del quale inizia la formazione dell’ossido/idrossido.
La regione di passività vera e propria inizia tuttavia in corrispondenza di un potenziale più elettropositivo, detto potenziale di passività Ep, in corrispondenza del quale la densità di corrente anodica scende a valori drasticamente minori (densità di corrente limite) che permangono quasi invariati per tutto un intervallo di potenziale, nella regione cosìdetta di passività.
Per potenziali superiori ad un potenziale detto di transpassività ETR, la corrente anodica inizia ad aumentare di nuovo. Il valore del potenziale a cui si entra nella regione di passività (Ep) è per molti materiali sensibilmente superiore a (Ecq)M/M0, mentre per metalli nobili come Au e Pt si ha Ep = (Ecq)M/M0.
Caratteristica importante da notare è che nella regione di passività la densità di corrente anodica è indipendente in buona misura dal valore assunto dal potenziale del metallo. Le possibili spiegazioni sono due:
Le condizioni che determinano la formazione di un film protettivo possono essere di tipo elettrochimico quando l’accoppiamento con un processo catodico (riduzione di O2 e/o scarica di H2 dall’acqua, ad esempio) comporta di lavorare ad un potenziale misto (Ecorr) superiore a quello di formazione dell’ossido (Ecorr > EeqMO), oppure di tipo imposto, quando il processo anodico è stimolato da un potenziale applicato dall’esterno mediante correnti impresse (in questo caso si parla di protezione anodica).
Bisogna sottolineare che non tutti i depositi superficiali o film di ossidi sono fortemente protettivi, in quanto questa proprietà dipende molto dalla continuità, compattezza, conducibilità ionica ed elettronica della barriera formata sulla superficie metallica rispetto all’ambiente corrosivo. Sui metalli come Pb, Cu, Cd, il fenomeno della passivazione è dovuto alla separazione di strati protettivi spessi costituiti da prodotti di corrosione sotto forma cristallina (PbSO4 per Pb in H2SO4 e Cu2(OH)3Cl per Cu in H2O di mare). Questi depositi sono protettivi sono quando si formano in modo compatto ed in spessori significativi. Per contro, sui metalli quali Ti, Fe, Cr, Co, Ni, tutti caratterizzati da una forte affinità per l’ossigeno, cioè ossidabilissimi, si formano film di ossidi estremamente sottili (pochi nm) ma molto continui e compatti, quindi efficaci nel proteggere il metallo sottostante dall’ambiente aggressivo esterno. La natura di questi film non è stata del tutto chiarita. La difficoltà di studio è dovuta alla necessità di osservarli e scoprirne la natura all’interno della soluzione acquosa in cui si forma, cioè in presenza del doppio strato elettrico (vedi dopo). Secondo alcuni autori sono film costituiti prevalentemente da ossidi in diretta corrispondenza con lo strato atomico superficiale, secondo altri sono meglio rappresentabili da uno strato adsorbito di O2. Ad ogni caso, per attivare la formazione di un film passivante di questo tipo, bisogna spingere il potenziale di lavoro del metallo al di sopra di un certo potenziale critico, sicuramente uguale o superiore al potenziale termodinamico di formazione dell’ossido dal metallo. Nei sistemi corrosivi reali questo è di norma conseguenza dell’azione di una o più reazioni catodiche che hanno luogo sulla stessa superficie del metallo, reazioni che spingono il metallo a lavorare a potenziali misti ( Ecorr) superiori del suo potenziale di equilibrio termodinamico.
Nella formazione e stabilizzazione del film passivante possono intervenire in senso favorevole composti presenti nell’ambiente e capaci di svolgere una azione passivante-ossidante, quali ad esempio i cromati (CrO4--); in questo caso i cromati, oltre a spingere il potenziale di lavoro del metallo verso valori sensibilmente più elettropositivi, si riducono e vanno a precipitare sulla superficie metallica come ossidi di Cr3+, migliorando le caratteristiche di compattezza e stabilità del film passivante proprio del metallo. Oppure altri ioni possono indurre il fenomeno della passivazione senza partecipare direttamente al fenomeno elettrochimico, come ad esempio i benzoati che precipitano come ferrobenzoati nell’ossido superficiale. Questa parentesi serve a far capire il principio di funzionamento di alcuni inibitori di corrosione aggiunti di proposito nell’ambiente, così come della formulazione di numerosi strati protettivi impiegati per proteggere dalla corrosione i componenti meccanici. Ad esempio, nel comune liquido aggiunto nel circuito di raffreddamento delle macchine, si impiega una miscela di inibitori tra i quali alcuni con funzionamento analogo ai cromati (prima si impiegavano proprio questi, poi, per problemi di tossicità, si sono sostituiti con nitriti): il potenziale redox così raggiunto è tale da permettere la passivazione del comune acciaio al C e mantenerlo passivo nel tempo. Inoltre, come noto, gli strati di conversione a base di cromo esavalente sono tra i più efficaci a proteggere componenti meccanici in acciaio e in acciaio zincato esposti a corrosione atmosferica,
E’ molto importante comprendere che i film di passivazione sono assai diversi dalla comune ruggine che vediamo sull’acciaio. Entrambi sono a base di ossidi del metallo base ma, mentre i primi sono assai sottili (pochi passi molecolari, al massimo pochi nanometri) e assai protettivi, la comune ruggine non protegge efficacemente il metallo sottostante, che continua a corrodersi. La ragione si comprende facilmente osservando il diverso meccanismo di formazione dei due strati di ossido. La ruggine, composta da FeOOH, praticamente ematite idratata, si forma nell’ambiente acquoso o nel film di condensazione presente e poi precipita per superamento del prodotto di solubilità sulla superficie metallica. Si comprende come tale deposito sia per sua natura poco coerente con il substrato metallico e poroso; l’ambiente aggressivo raggiunge sempre e comunque il metallo e continua a corroderlo. Solo pochissimi depositi cristallini spessi (si contano sulle dita di una mano) riescono ad essere efficacemente protettivi (passività chimica prima detta)
Il meccanismo di formazione di un film passivante di ossidi è invece completamente diverso. Per visualizzare tale differenza, consideriamo uno dei metalli che esibisce passività, come il nichel, potendo ripetere le stesse considerazioni per il cromo, il titanio ecc. Partendo dall’iniziale ossidazione dell’atomo metallico superficiale di nichel, quest’ultimo può:
Se consideriamo a titolo di esempio la catena di ossidazione del nichel:
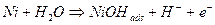
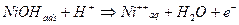
Lo ione in soluzione acquosa può quindi precipitare come idrossido sulla superficie metallica, nel caso in cui il pH della soluzione sia tale da far superare il prodotto di solubilità dell’idrossido.
2- Esiste tuttavia un’altra possibilità, e cioè che l’intermedio NiOHads si deprotoni e resti sulla superficie metallica senza andare a formare all’interno della soluzione uno ione solvatato. La deprotonazione possiamo rappresentarla come:
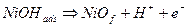
In questo caso si ha formazione dell’ossido superficiale direttamente a partire dalla superficie metallica. Il film di ossido è in questo caso coerente e continuo con il metallo, molto protettivo in quanto capace di isolarlo efficacemente dal contatto con l’ambiente aggressivo. In tali condizioni possiamo anche immaginare il film passivante di ossido come un gruppo OH- adsorbito direttamente sulla superficie, oppure come uno strato di ossigeno adsorbito.
Quale delle due reazioni ha il sopravvento, dipende dal tipo di ambiente corrosivo, dal suo pH, dal potenziale e anche dalla temperatura. La formazione dell’ossido passivante è comunque possibile solo se il potenziale di equilibrio di formazione dell’ossido è raggiunto e superato. Naturalmente, questo accade più facilmente in soluzioni neutre o basiche.
Anche in ambiente acido, dove l’ossido è tendenzialmente instabile, può verificarsi passivazione. In questo caso la velocità di dissoluzione dell’ossido determina l’intensità del fenomeno corrosivo. Ad esempio il cromo (così come gli inox) possono esibire buona passivazione anche in ambienti acidi in quanto gli ossidi di cromo III si dissolvono in modo abbastanza lento
Come prima accennato, in alcuni casi il deposito formato per precipitazione dalla soluzione può risultare efficacemente protettivo, anche se non passivante in senso stretto. E’ il caso dell’AgCl su Ag, del FeSO4 per acciai al carbonio in H2SO4 concentrato, del PbSO4 in H2SO4 diluito. Questi depositi risultano molto più spessi dei film di ossidi passivanti e l’attacco corrosivo al metallo è sensibilmente, ma non drasticamente, ridotto.
Le variabili ambientali che bisogna considerare attentamente nel valutare l’impiego di un materiale a comportamento attivo-passivo sono:
Il tasso corrosivo di un materiale metallico è influenzato da tutti quei fattori che possono modificare le specifiche condizioni termodinamiche e cinetiche del processo corrosivo stesso. I principali fattori che concorrono nella definizione del processo elettrochimico possono ricondursi:
La natura e composizione chimica del materiale influenza essenzialmente la nobiltà del processo anodico e l'entità della resistenza offerta nei processi elettrodici. In funzione del particolare accoppiamento metallo-ambiente possono inoltre manifestarsi fenomeni di passività chimica o fisica in relazione all'ambiente ed alle tensioni anodiche raggiunte.
I materiali metallici sono costituiti da un gran numero di cristalli di piccole dimensioni chiamati grani. In seguito ai trattamenti termici o meccanici, tali grani possono assumere orientazioni preferenziali che modificano i valori della polarizzazione e possono facilitare l'innesco di fenomeni corrosivi. Nelle zone di collegamento tra grano e grano vi sono schiere distorte di atomi in posizioni intermedie tra i grani, e quindi tali da risultare in condizioni di maggiore reattività. In tali zone vengono poi a concentrarsi, per effetto di microsegregazione, sensibili quantità di impurezze o anche a prodursi variazioni di composizione chimica a causa di precipitazione di intermetallici. Tali zone sono quindi spesso regioni di attacco c. preferenziale (vedi anche la c. intergranulare). Tuttavia, anche all'interno dei grani possono esserci difettosità varie quali difetti puntiformi, lineari (dislocazioni) o di superficie (geminati, stacking faults).
SOLLECITAZIONE
E' noto che imponendo adeguate deformazioni plastiche a freddo, si possono aumentare caratteristiche meccaniche quali la durezza e carico di snervamento dei materiali. A seguito di questi trattamenti si verificano però anche decrementi della resistenza a c. del materiale. Le ragioni sono molteplici; a livello termodinamico è probabile che vi sia un'influenza sull'attività degli atomi costituenti il materiale metallico (aspetto non ben chiarito), mentre a livello cinetico è ragionevole ipotizzare l'effetto di una più alta densità di difetti reticolari, così come di eventuali tessiture cristallografiche e, in definitiva, di una maggiore disomogeneità microstrutturale. Nel caso di materiali a comportamento attivo-passivo, é anche probabile che gli strati superficiali protettivi siano meno compatti e più difettosi, e quindi meno capaci di svolgere la loro azione schermante. Le sollecitazioni meccaniche indotte da carichi esterni o anche relative a stati autotensionali, diminuiscono ulteriormente la resistenza alla corrosione dei materiali. L'azione combinata di una tensione imposta al materiale in un ambiente corrosivo, è in molti casi molto più deleteria del danneggiamento apportato dalle due cause separate. In tali circostanze possono infatti facilmente innescarsi fenomeni come la Stress-Corrosion-Cracking (S.C.C.), la Hydrogen-Stress-Cracking e la Corrosione-Fatica, capaci di indurre insidiosi ed intensi danneggiamenti ai componenti meccanici o strutturali.
L'ambiente corrosivo definisce, mediante le sue caratteristiche chimico-fisiche, la natura e nobiltà dei processi elettrodici, ma anche fattori cinetici quali l'entità delle sovratensioni e la stessa possibilità di raggiungere condizioni di passivazione superficiale. Tra le caratteristiche più importanti ricordiamo:
- ACIDITA'
L'influenza del pH, come già detto a proposito dei diagrammi di Pourbaix, si esplicita nello stabilire la forza motrice disponibile al processo corrosivo, nonché la possibilità T.D. di precipitazione di ossidi, idrossidi e sali basici, composti che spesso portano alla passivazione del materiale per schermatura. In Fig.4.1 è descritto qualitativamente l'andamento della velocità di attacco di alcuni metalli al variare del pH.
Fig.4.1
- POTERE OSSIDANTE
Il potere ossidante di un ambiente è definito dalla nobiltà del processo catodico che in esso si produce, cioé misurato dal valore della tensione di equilibrio e dall'andamento della relativa caratteristica tensione-corrente. Un aumento di potere ossidante si esplica mediante un incremento della tensione catodica e/o una minore pendenza della curva caratteristica elettrodica. In caso di condizioni generalizzate di attività di un materiale metallico, la disponibilità di un maggior lavoro motore, si traduce in velocità di c. più elevate; tuttavia, nei materiali che esibiscono un comportamento attivo-passivo, tale incremento potrebbe anche comportare il raggiungimento delle condizioni di passivazione e quindi causare un decremento della velocità di c..(v. Fig. 4.2).
ALL'AMBIENTE
- TEMPERATURA
L'influenza della temperatura sul fenomeno corrosivo non può essere valutata tout-court, poiché il processo c. è il risultato di processi sia elettrochimici, che chimici (reazioni omogenee) e fisici (diffusione, solubilità). In particolare, la temperatura influisce sulla T.D. della corrosione, sulle sovratensioni (che diminuiscono), sulla conducibilità e sui coefficienti diffusivi (che aumentano), sulla solubilità dei prodotti di c. (che in genere aumenta) e sulla solubilità dei gas disciolti (che diminuisce).
- CONDIZIONI DI MOTO RELATIVO
Le condizioni di moto relativo tra soluzione aggressiva e superficie metallica possono influire in vario modo. Nel caso ad es. di un materiale non passivabile in cui la velocità della corrosione è controllata dall'apporto di O2, un aumento della velocità del fluido si traduce in un aumento della velocità di corrosione, v. Fig. . Tuttavia nel caso di materiali a comportamento attivo-passivo, nelle stesse condizioni di cui sopra, un maggiore apporto di O2 potrebbe invece determinare l'instaurarsi di una passività generalizzata.
Le condizioni di corrosione più pericolose si verificano spesso quando sono presenti condizioni di elevata turbolenza con conseguenti urti, ad esempio, in corrispondenza di brusche variazioni di direzione del fluido, oppure quando si presentano fenomeni di abrasione-erosione con fluidi contenenti particelle sospese. In questi casi si verifica la cosìdetta corrosione per 'impingment' spesso riscontrata nei tubi degli scambiatori di calore con fluido refrigerante movimentato a velocità eccessiva (corrosione a "dente di sega" delle leghe di rame). La condizione più gravosa si verifica all'imbocco dei tubi in corrispondenza della piastra tubiera, tanto da dover prevedere l'impiego apposite guaine di protezione.
Molto pericolose sono anche le forti oscillazioni di pressione, in relazione ai fenomeni di cavitazione che consistono nella rapida formazione e condensazione di bollicine di vapore. Il distacco ed impatto del liquido e del vapore così formati provoca notevole danno erosivo ed anche corrosivo, in quanto viene prontamente distrutto il film protettivo superficiale con formazione di profonde cavità nel metallo. Casi tipici sono le brusche variazioni di pressione nei circuiti di raffreddamento ad H2O (strozzature o angolazioni brusche) e sulle eliche delle navi (incorretto design).
L'attacco corrosivo alle superfici metalliche può essere di tipo diffuso (Corrosione Generalizzata) o può concentrarsi solo su alcune regioni del materiale lasciando le restanti sostanzialmente inalterate (Corrosione Localizzata e Corrosione Selettiva).
Nella Corrosione Generalizzata l’intera superficie del metallo appare danneggiata e la penetrazione del danneggiamento all’interno del materiale può considerarsi grosso modo costante. In questo caso le aree anodiche e catodiche sono assai piccole e ripartite in modo uniforme sull’intera superficie esposta, senza significative localizzazioni. La velocità di corrosione si esprime di norma come penetrazione dell’attacco in millimetri/anno (mm/anno);
La Corrosione Localizzata può presentarsi con morfologie molto particolari e differenziate a seconda del diverso meccanismo dell'attacco corrosivo; può procedere ad esempio come fenditure o come cricche normali alla superficie del materiale, o può dar luogo a cavità che a seconda della forma assunta sono detti crateri, punte di spillo ecc ;
Nella Corrosione Selettiva si ha invece un attacco preferenziale a particolari costituenti strutturali del materiale metallico, o si ha dissoluzione nelle regioni adiacenti il bordo dei grani ecc.
In Figura sono riportati alcuni aspetti morfologici tipici dei fenomeni corrosivi. Mentre in condizioni di attacco generalizzato la "velocità" di perdita di massa espressa in mdd = mg/dm2 giorno (o in mm/anno ottenuta dalla precedente dividendo per la densità del materiale metallico),esprime l'entità del danno realizzato, nel caso di corrosione localizzata tale parametro perde naturalmente ogni significato; in questo caso si preferisce definire la grandezza "intensità" di attacco che tende a dare una misura della massima penetrazione dell'attacco (è in pratica la velocità di penetrazione misurata nel punto di massimo attacco). Naturalmente i valori della velocità e dell'intensità di attacco coincidono nel caso di corrosione uniforme, mentre tendono a divergere per forme di corrosione via via più localizzate; il loro rapporto può quindi essere considerato un indice della localizzazione stessa dell'attacco corrosivo.
L'attacco corrosivo localizzato è usualmente molto pericoloso sia per l'estrema velocità con cui esso procede, sia per la difficoltà stessa di monitoraggio del danno subito dal componente.
Le principali forme di corrosione localizzata sono:
- CORROSIONE PER CONTATTO GALVANICO;
- CORROSIONE PER VAIOLATURA ED IN FESSURA;
- CORROSIONE INTERGRANULARE;
- CORROSIONE PER TURBOLENZA, ABRASIONE, CAVITAZIONE;
- CORROSIONE SOTTO SFORZO;
- CORROSIONE-FATICA.
Questa tipo di corrosione si verifica quando due o più materiali metallici o comunque dotati di conducibilità elettronica (grafite, ossidi o solfuri conduttori, ecc;) sono in contatto elettrico tra loro. Si intende per corrosione galvanica l'aumento della velocità di danneggiamento, che dipende in buona misura dalla loro distanza nella serie galvanica in quell’ambiente, dal rapporto tra aree anodiche e catodiche nei materiali, dalle caratteristiche di polarizzabilità dei materiai in quell’ambiente. Il metallo più nobile funge da catodo e quello meno nobile da anodo, dissolvendosi.
E' possibile ordinare i metalli secondo il potenziale di corrosione libera (nobiltà pratica in quell’ambiente) che assumono quando sono in contatto con un dato elettrolita (Serie Galvanica). In genere sono più pericolosi gli accoppiamenti tra metalli molto distanti tra loro nella serie galvanica anche se l'entità dell'attacco può dipendere anche in maggior misura dai fattori cinetici che poi intervengono nel processo.
Il processo di corrosione galvanica ha luogo anche quando sulla superficie di un materiale vi sono impurezze di un altro metallo e viene a crearsi una pila cortocircuitata, con passaggio in soluzione del metallo meno nobile (questo accade anche anche tra metalli e ossidi conduttori; il caso ferro/scaglia di magnetite è il più comune). Supponiamo ad es. di avere un'impurezza di Cu su Fe. Allora, essendo ECu++ /Cu = 0,337V e EFe++/Fe = - 0,41V il metallo meno nobile (Fe) manda in soluzione ioni Fe2+ secondo la semireazione: Fe Fe2+ + 2e-.
Gli elettroni migrano verso il materiale più elettropositivo cioé il Cu, dove potrebbero ridursi sia gli stessi Fe2+ che l'O2 dell'aria. La riduzione dell'O2 secondo la semireazione: O2 + 2H2O + 4e 40H- ha un potenziale standard pari a 0,401 V; il potere ossidante è quindi ben maggiore di quello della coppia Fe2+/Feo. Sul catodo, costituito dal Cu vi sarà produzione di ioni ossidrilici OH- con possibile precipitazione di Fe(OH)2 [sale poco solubile Kps = 2x10-15], sottraendo ioni Fe2+ dalla soluzione e quindi favorendo passaggio di nuovi ioni metallici in soluzione.
Si diminuisce il pericolo di c. per contatto galvanico scegliendo combinazioni di metalli di nobiltà simile, evitando alti rapporti Scat./San., interponendo isolanti, o anche usando inibitori di corrosione o anodi sacrificabili.
Per "vaiolatura" o "pitting" s'intende una forma di corrosione localizzata con effetto perforante che colpisce i materiali a comportamento attivo-passivo quali il Fe, Al, Cu , Ti, Ni, Cr e loro leghe (in particolare gli acciai inossidabili) quando il potenziale che essi assumono (per effetto della reazione catodica) non è tale da assicurare la formazione di uno strato continuo e protettivo sulla superficie del materiale. Il pitting si verifica in genere in ambienti a carattere ossidante molto debole, contenenti ioni specifici (ad es. cloruri, perclorati, ecc;) oppure in ambienti ossidanti forti (anche qui favorito per presenza di ioni depassivanti). In tal senso, l'acqua di mare risulta un ambiente particolarmente favorevole a questo tipo di corrosione.
Un pit superficiale procede attraverso uno stadio di innesco e successiva propagazione. L'innesco può verificarsi in corrispondenza dei punti in cui il film passivo è più debole, come per inclusioni superficiali, difetti del materiale, bande di scorrimento affioranti: l'area scoperta diviene anodica e si innesca un processo corrosivo violento, essendo SC/SA estremamente grande.
Al processo di innesco segue quello di propagazione, che ha in genere carattere autostimolante ed è dovuto all’istaurarsi di una coppia galvanica, come rappresentato in Fig. per un metallo esposto ad una soluzione areata di NaCl : la reazione catodica ha luogo su di una vasta area esterna al pit e la formazione di ioni OH- contribuisce a rendere ancor più catodiche le superfici esterne al pit. L'O2 del resto non riesce ad entrare all'interno della cavità sia per la sensibile diminuzione della sua solubilità (conseguente all'aumentata concentrazione della soluzione), sia per impedimenti geometrici
All'interno del pit si ha, per contro, idrolisi dello ione metallico M++ con locale aumento dell'acidità locale M++ + 2H2O = M(OH)2 + 2H+. Infine, per trasporto elettroforetico aumenta anche la concentrazione locale di Cl-, con ulteriore incremento dell'aggressività ambientale nel pit. Partendo da una soluzione neutra con pohe decine di ppm di ioni cloro nella soluzione aggressiva, si può arrivare con questo meccanismo ad avere pH molto acidi all’interno del pit (pH = 2-3) con tenori di cloruri anche di alcune centinaia di ppm.
La c. interstiziale è una forma di c. localizzata ad azione cavernizzante che insorge in corrispondenza di interstizi o altri punti schermati per i quali risulta difficoltoso il ricambio della soluzione tra le zone più interne e la massa della soluzione. L'ossigeno o le altre specie ossidate non riescono a raggiungere le zone interne schermate e quindi a sostenere in loco lo stato di passività. Pertanto, si intuisce che anche la c. interstiziale è a carattere autostimolante: si deternima il funzionamento catodico delle aree esterne liberamente raggiungibili dall'ossigeno ed il funzionamento anodico delle aree più interne più limitate nella superficie e quindi con correnti anodiche di elevata densità. In tal modo, la corrosione interstiziale si verifica più facilmente del pitting in quanto, esistendo già l’interstizio, si salta la fase di innesco.
Per avere un’idea delle resistenze a pitting ed a corrosione interstiziale dei diversi materiali metallici da costruzione, si riportano alcuni dati tratti dalla letteratura tecnica. Si confrontano cioè le temperature critiche di innesco del pitting e della c.interstiziale operando come segue: si impiega una soluzione aggressiva di laboratorio composta da 4% di NaCl + 0,1% Fe2(SO4)3 + 0,01 M HCl, soluzione fortemente ossidante e contenente ioni cloruro come depassivanti, si immergono i campioni per 24 ore nella soluzione variando la temperatura di 5 gradi centigradi per volta e si determinano le temperature critiche di pitting e di c. interstiziale quando sono osservabili attacchi corrosivi con un microscopio ottico a 40 X. I provini per il pitting sono semplici sbarrette del metallo, mentre i provini per la c. interstiziale sono provini sulla cui superficie viene premuto mediante elastico un cilindretto di Teflon al fine di creare un interstizio. Si esamini la tabella seguente.
|
Temperatura criticadi pittng |
Temperatura critica di c.interstiziale |
Hastelloy C-22 |
> 150 |
102 |
Hastelloy C-276 |
150 |
80 |
Hastelloy H |
95 |
55 |
Ferralium 255 |
50 |
35 |
Lega 904L |
45 |
20 |
AISI 317L |
25 |
15 |
AISI 316 |
20 |
< -5 |
Si può osservare che le temperature critiche diinnesco della c. interstiziale sono sempre più basse di quelle di innesco della c. per pitting. Si apprezzi inoltre la forte differenza di resistenza tra un AISI 316 e un Hastelloy tipo C. E’ opportuno sottolineare che questa tabella è utile per un confronto qualitativo tra diversi materiali e che le temperature riportate hanno una stretta attinenza all’ambiente corrosivo impiegato. In altre parole, in acqua di mare, le temperature critiche di innesco pitting per un AISI 316 sono senza dubbio superiori di 20 °C.
La c. intergranulare si verifica in corrispondenza dei bordi di grano, senza agire in maniera apprezzabile sulla matrice dei grani stessi. E' un attacco insidioso poiché può penetrare profondamente nel metallo senza che i prodotti di corrosione risultino visibili sulla superficie esterna. Il distacco dei legami intergranulari comporta ovviamente la degradazione delle proprietà tecnologiche del materiale. Nel caso di metalli o leghe spesso intervengono fattori strutturali di disomogeneità quali l'accumulo di impurezze, segregazione o precipitazione di fasi particolari (sensibilizzazione), che possono creare condizioni favorevoli per una dissoluzione selettiva. Alte velocità di penetrazione possono raggiungersi quando si possono formare microelementi galvanici in corto circuito in cui il bordo del grano diviene anodico (SA) ed il corpo del grano catodico (SC) con SC>>SA, per cui le densità di corrente anodiche possono raggiungere valori assai elevati. In questo caso le condizioni elettrochimiche sono del tutto analoghe a quelle di innesco del pitting. Pertanto è necessario che, al di là dei necessarie condizioni favorevoli da un punto di vista metallurgico, l'ambiente sia solo blandamente aggressivo, in modo da assicurare condizioni di dissoluzione selettiva.
La c. intergranulare colpisce sia metalli che leghe. Ad esempio l'alluminio commerciale che, se trattato a 600 °C, si sensibilizza per precipitazione sui bdg di impurezze (Fe,Si) e subisce questo tipo di attacco se in contatto con HCl o alcali. Le leghe Al-Cu (durallumini) si possono sensibilizzare per precipotazione di CuAl2 ai bdg con impoverimento di rame nelle zone di precipitazione che diventano anodiche rispetto al corpo del grano. Anche gli acciai inox austenitici possono sensibilizzarsi in seguito a trattamenti a temperature tra 400-850 °C anche per tempi brevi. In queste condizioni precipitano dei carburi di cromo (M23C6) sui bdg provocando un impoverimento di cromo libero nelle regioni adiacenti, che risultano così più difficilmente passivabile, v. Fig. . Si ricorda che il tenore di Cr libero nell'inox non deve scendere al di sotto del 12 %, se si vuole garantire la formazione di un film compatto e protettivo. La sensibilizzazione degli acciai inox è un fenomeno frequentemente collegato con i processi di saldatura e può essere in genere evitato con l'uso di acciai a basso contenuto di carbonio (ad es. AISI 304L, 316L, L=low carbon) oppure di acciai stabilizzati contenenti in lega piccole quantità di titanio o niobio (AISI 321 al Ti, AISI 347 al Nb), in cui durante un trattamento termico di stabilizzazione si induce la precipitazione omogenea nella struttura di TiC o NbC, sottraendo carbonio dalla matrice ed impedendo la precipitazione di carburi di cromo durante saldatura.
La c. sotto sforzo è un tipo di corrosione localizzata che si realizza con la formazione di cricche assai sottili in seguito all'azione combinata di un mezzo corrosivo di blanda aggressività, ma specifico per un dato materiale metallico, e di uno stato di sollecitazione di trazione di entità anche non rilevante. Il fenomeno è particolarmente pericoloso in quanto può dar luogo ad improvvisi cedimenti del materiale, senza che questo sia visibilmente deteriorato. La SCC colpisce una vasta gamma di materiali metallici come gli acciai al carbonio, gli acciai inossidabili, le leghe leggere, leghe di rame e titanio, ecc., sotto l'azione di ambienti di natura alquanto differenziata (alogenuri, nitrati, solfuri, soluzioni caustiche ecc.). Per l'innesco della SCC devono comunque verificarsi le seguenti condizioni:
1 - è necessaria la presenza di tensioni di trazione. Tali tensioni possono derivare oltre che da carichi esterni applicati, anche da stati autotensionali causati da montaggi forzati, dilatazioni termiche o cedimento di vincoli;
2 - 'attacco si produce solo su leghe metalliche e, generalmente, non su metalli puri.
3 - l'attacco si produce solo per specifiche combinazioni ambiente - M.M.
4 - la presenza di alcuni elementi di lega può aumentare la suscettibilità di un metallo o determinarne l'immunità. Ad esempio, la presenza di azoto negli acciai inox aumenta la suscettibilità alla SCC in MgCl2 bollente. La presenza di Si (1,5 %) diminuisce la sensibilità di certi ottoni in ambienti ammoniacali.
La SCC si realizza con formazione di cricche orientate perpendicolarmente alla direzione della tensione meccanica applicata. Queste possono essere inter/trans-granulari, seguendo comunque una o più direzioni principali, con piccole ramificazioni assai caratteristiche.
Sotto l'aspetto fenomenologico l'attacco si sviluppa sempre attraverso un innesco di cricca per pitting, per poi propagarsi all’interno del materiale sotto l'azione combinata delle tensioni di trazione e dell’ambiente corrosivo. Una volta iniziato, il danneggiamento procede all'interno del materiale con un meccanismo complesso (non del tutto chiarito) che comporta stadi susseguenti di dissoluzione elettrochimica all'apice della cricca e di frattura meccanica. L'instaurarsi di coppie galvanicche tra apice della cricca (area anodica) e pareti della stessa (area catodica) e il possibile intervento di fenomeni infragilenti (ad es. in materiali suscettbili all’infragilimento da idrogeno) sul fronte di avanzamento della cricca, possono dar luogo a velocità di avanzamento anche estremamente alte (mm/ora).
I casi più comuni di SCC si riferiscono agli acciai al C in presenza di nitrati (industria dei fertilizzanti), cianuri, solfuri, soluzioni caustiche concentrate (infragilimento caustico). Gli acciai inox sono suscettibili in ambienti contenenti cloruri o solfuri. Il rame e sue leghe possono criccarsi velocemente in presenza di ammoniaca, nitriti, nitrati, SO2, fluoruri ecc..
I metodi di prevenzione della SCC consistono nella scelta di materiali non suscettibili di cracking negli ambienti in cui si impiegano, nell'evitare inquinanti pericolosi, nell'eliminare la presenza di sollecitazioni meccaniche in fase di montaggio o servizio e nell'evitare tensioni di saldatura. Possono rivelarsi utili anche trattamenti di pallinatura e di protezione catodica.
Nei materiali metallici sottoposti ad un carico variabile e ripetuto nel tempo possono insorgere delle cricche, dette di fatica, e propagarsi fino a portarli a rottura, anche per un valore del carico massimo applicato molto inferiore al carico statico sopportabile dal componente. Questo meccanismo di danneggiamento è noto come fatica meccanica ed è molto spesso responsabile della rottura dei componenti meccanici sollecitati in tal modo. La rottura per fatica meccanica ha una prima fase di innesco sempre sulla superficie esterna del componente dove, per la presenza di difettosità o fattori geometrici che portano a intensificazione degli sforzi, viene a formarsi una microcricca. Questa si propaga poi all’interno del materiale sotto l’azione delle sollecitazioni cicliche applicate, seguendo un percorso ortogonale all’asse del carico applicato. Man mano che la cricca avanza, aumenta l’effetto di concentrazione degli sforzi all’apice della cricca, fin a giungere alle condizioni critiche di innesco della rottura di schianto. La tipica superficie di frattura per fatica è costituita da una larga parte di sezione macroscopicamente liscia (avanzamento sub-critico), dove ad alto ingrandimento possono osservarsi le così dette ‘linee di spiaggia’, e da una parte finale in genere fibrosa e opaca, corrispondente alla rottura finale di schianto (avanzamento critico).
Questo meccanismo di danneggiamento può essere promosso e accelerato nel caso il componente meccanico si trovi a lavorare in un ambiente corrosivo. In questo caso, la formazione di pit superficiali o comunque corrosioni di tipo localizzato, costituiscono in pratica l’evento iniziale di innesco del danneggiamento. Inoltre, anche la successiva fase di avanzamento della cricca all’interno del materiale può essere sensibilmente accelerata. Si parla in questo caso di corrosione-fatica. Le superfici di frattura appaiono nel tratto di avanzamento subcritico piene di prodotti di corrosione, formatisi nel tempo sulle pareti della cricca.
Se l’ambiente aggressivo è anche conducibile ad un fenomeno di tensocorrosione, questi danneggiamenti possono sommarsi tra di loro e velocizzare notevolmente il procedere delle cricche. In questo caso non è raro osservare diramazioni secondarie ramificate lungo la cricca principale.
Una volta innescato questo tipo di danneggiamento, non è più possibile arrestarlo. Occorre quindi evitare assolutamente che l’ambiente corrosivo riesca a promuovere la formazione di attacchi localizzati che possano favorire una intensificazione degli sforzi e far partire il danneggiamento per fatica. E’ quindi sbagliato andare a cercare materiali metallici più altoresistenziali o anche materiali di pari resistenza ma maggiore duttilità, oppure materiali più nobili che però non garantiscono contro possibile pitting superficiale. In genere, il rimedio più efficace è quello di usare rivestimenti protettivi capaci di protezione passiva e attiva (catodica), che impediscano corrosioni superficiali sul componente metallico. In alcuni casi può essere efficace una protezione per correnti impresse.
Questi casi di corrosione sono correlati al moto relativo dell'ambiente corrosivo contenente particelle solide o bolle di gas trascinate. Il film protettivo superficiale viene danneggiato localmente dall'azione meccanica di abrasione, cui fa seguito un attacco corrosivo accelerato dal forte rapporto SC>>SA (zone adiacenti ancora passive).
TURBOLENZA L'attacco corrosivo si innesca in prossimità di difettosità superficiali; nel procedere del processo, l'attacco si intensifica per incremento successivo della turbolenza stessa.(Ad es. giranti di pompe, palette turbine, agitatori, gomiti, imbocchi ecc.).
ABRASIONE Quando l'ambiente corrosivo in movimento trascina con sé particelle in sospensione (polveri di catalizzatore, sabbia, sali precipitati ecc.),l'azione meccanica esercitata sul materiale metallico può essere incisiva anche per velocità modeste. Tale azione si esalta laddove, per qualsiasi motivo, si innalza la concentrazione delle particelle solide (estradosso di una curva, piede di tubazioni verticali).
CAVITAZIONE In presenza di moto relativo ad alta velocità tra ambiente e materiale (palette di una girante) o di bassa pressione (parte alta di apparecchiature) o in presenza di vibrazioni, la pressione può scendere al di sotto della tensione di vapore del fluido e dar luogo a bolle gassose che, collassando, generano onde d'urto che possono causare fenomeni di fatica e deformazioni permanenti al materiale. Le superfici diventano spugnose a causa dei profondi crateri che si vengono a formare.
I materiali più duri resistono in genere meglio a questi tipi di danneggiamento a patto che la loro durezza non sia ottenuta troppo a scapito dell'omogeneità del materiale. Importante è anche la compattezza e resistenza del film passivante e la sua capacità di cicatrizzarsi; non vanno in genere bene film spessi (Cu, Pb) ma meglio quelli del tipo acciai inox.
La corrosione filiforme è un particolare tipo di corrosione in fessura. Ha luogo, in prevalenza, al di sotto dei film protettivi, ed è comune nei barattoli, bidoni ecc.. dell’industria alimentare esposti all’umidità atmosferica.
Si produce su acciaio, manganese e alluminio ricoperti con stagno, argento, fosfato ecc. Il danno non è strutturale, ma estetico: si formano tracce rettilinee caratterizzate da una punta attiva (ioni ferrosi) colore rosso/blu e da una coda inattiva (ioni ferrici) rosso/marrone.
Il fattore ambientale più importante è l’umidità dell’atmosfera: il fenomeno ha luogo per umidità relative comprese tra il 60 e il 90 %, l di sopra il danneggiamento ha luogo tramite blistering.
Si è visto che il tipo di ricoprimento non ha molta importanza, se non riguardo alla relativa permeabilità dell’acqua dell’atmosfera. Non c’è influenza della microstruttura, né risulta importante l’attività biologica. Il meccanismo non risulta ben chiaro. Sulla punta, per effetto dell’alta concentrazione di [Fe2+],si ha rifornimento di H2O dall’esterno per osmosi, meccanismo mediante il quale viene sottratta anche acqua dalla coda inattiva (bassa [Fe3+] in soluzione). La concentrazione di O2 all’interfaccia testa coda è alta; la corrosione è localizzata soprattutto sulla testa , dove l’idrolisi degli ioni ferrosi diminuisce il pH. La mancata propagazione laterale della testa e il tipo di interazione tra i filamenti, non è stata compresa.
Per quanto riguarda la prevenzione, è importante impiegare film con bassa permeabilità all’H2O.
La corrosione biologica non è un particolare tipo di corrosione, ma un danneggiamento del metallo per corrosione, conseguente, direttamente o indirettamente, all’attività di organismi viventi. Questi possono essere macrorganismi, come molluschi e funghi, e in questo caso il processo corrosivo è facilitato dall’azione di schermo (crevice corrosion) oppure microrganismi, in genere batteri solfato-riduttori, ferrobatteri e solfobatteri.
Il termine MIC (Microbiological Induced Corrosion) si riferisce alla corrosione influenzata dalla presenza e dall’attività di microrganimi e/o dai loro metaboliti.Quando una superficie metallica si trova a contatto con acque naturali o industriali (dolci, salmastre o di mare ), con terreni o con qualsiasi altro ambiente biologicamente attivo, viene colonizzata da microrganismi presenti nella fase acquosa, che formano i cosiddetti biofilm ( o feltri biologici ). Questi sono costituiti da colonie di organismi della stessa specie o più spesso di specie diverse con morfologia, colore, architettura, condizioni di sviluppo o di sopravvivenza, e perfino meccanismo di comunicazione ( segnali chimici ) diversi. Queste colonie sono tenute assieme da sostanze, spesso gelatinose, prodotte dai microrganismi stessi, che, oltre a svolgere il compito di far aderire alla superficie metallica i biofilm, modificano localmente la composizione chimica (anzitutto il pH ed il tenore di ossigeno ) e creano microambienti adatti per la proliferazione di altre specie.
I microrganismi che interessano la corrosione sono generalmente batteri, funghi, alghe e diatomee.
Sebbene i batteri possano predominare, muffe, lieviti e protozoi possono anche associarsi ai batteri e, sotto determinate condizioni, possono causare corrosione per conto proprio, o modificarsi drasticamente.
Benchè molti degli effetti dei microbi nel metallo siano associati alla crescita, non è necessariamente così: una volta stabilita la biomassa, questa può cessare di crescere ma continua la sua attività chimica, spesso anche più velocemente, una volta che diminuisce il controllo sulla crescita.
I batteri possono esistere in diversi stati metabolici:
Le famiglie di batteri che causano la corrosione sono moltissime. Per limitarci a quelle che interessano gli acciai al carbonio e gli inossidabili, citiamo tre tipi di batteri:
Si può notare come i batteri coinvolti nei processi di corrosione più importanti sono quelli che hanno metabolismo nel quale giocano un ruolo importante lo zolfo e i suoi composti e così pure quelli connessi con il “ ciclo naturale dello zolfo “.
Esso è meno familiare di quelli rispettivamente dell’O2 e dello N2 , tuttavia riveste un ruolo importante soprattutto per quanto riguarda la corrosione industriale. E’ un ciclo continuo di variazione biologica
Uno dei metodi più diffusi ed efficaci per la protezione dei materiali metallici dal degrado ambientale è quello di applicare sulla loro superficie film o strati resistenti alla corrosione, in modo da isolare fisicamente (protezione passiva) il materiale metallico dall’ambiente aggressivo circostante (placcature metalliche, smalti, rivestimenti organici a spessore, pitture e vernici). L’efficacia della protezione passiva è però funzione dell’integrità del ricoprimento. Spesso, pertanto, si impiegano strati capaci di proteggere anche per inibizione o per protezione catodica il materiale (protezione mista). Possono esserci anche altre finalità del ricoprimento, come ad esempio un fattore estetico o una azione biocida.
Possiamo distinguere in: placcatura, incamiciatura e rivestimenti sottili (da deposito) formati in loco. La placcatura di materiali resistenti a corrosione su materiali resistenti meccanicamente viene realizzata per colaminazione o per riporto di saldatura, e comunque realizzando in tal modo una continuità cristallografica e un legame metallurgico tra i diversi materiali. Vi sono problemi per la definizione dei trattamenti termici da condurre sull’intero manufatto, così come accorgimenti da adottare per le saldature di ripristino. Quando non vi sono particolari requisiti di servizio (problemi di scambio termico o alte pressioni) si può ricorrere ad una semplice incamiciatura, saldata per punti sull’apparecchio già costruito. Questi metodi richiedono una quantità importante di materiale pregiato, sono costosi e possono impiegarsi per apparecchiature di forma geometrica semplice.
Più economici e di semplice applicazione, da impiegarsi quindi a pezzi di geometria più complessa, sono i rivestimenti da deposito. Bisogna siano spessi, compatti ed aderenti al substrato per essere protettivi, ed inoltre è bene che siano anodici rispetto al materiale da proteggere, in modo da offrire al substrato anche protezione catodica.
I metodi più usati sono:
Altre tecniche sono la metallizzazione sottovuoto (vapor deposition), cromizzazione (cromo) e colorizzazione (alluminio) e la deposizione a spruzzo (flame/plasma spraying).
La deposizione a caldo si applica soprattutto sugli acciai, applicando rivestimenti di metalli a basso punto di fusione (Zn, Pb, Sn, Al). I problemi che si incontrano sono, a parte una preparazione adeguata della superficie, nella bagnabilità del substrato ad opera del bagno fuso (hot dipping, procedimento per immersione). Nel caso dello zinco su acciaio vi è una certa solubilità reciproca, e pertanto si verifica la formazione di leghe ferro-zinco. Gli strati normalmente depositati sono dello spessore di qualche decina di micrometri.
La deposizione galvanica, o elettrodeposizione, consiste nell’immergere il pezzo da rivestire in una soluzione contenente il metallo da depositare, e facendo passare corrente tra il pezzo e un elettrodo di lavoro. In funzione del metallo da depositare e delle condizioni operative adottate (temperatura, composizione del bagno, tempo e additivi specifici) si possono ottenere film sottili di diversi micrometri o anche spessi fino a qualche mm. Lo strato superficiale, può essere composto da un singolo ricoprimento o da più strati. Per esempio, i paraurti cromati (di qualità) che si usavano per le automobili avevano un primo strato di rame (per l’adesione) uno secondo di nichel (protezione dalla corrosione) e uno finale di cromo (estetico).
La scelta tra l’elettrodeposizione e il metallo di immersione dipende molto dall’impiego del manufatto. In generale, se sono richiesti depositi coprenti di piccolo spessore, si sceglie l’elettrodeposizione, in quanto è più facile dosare il materiale di placcatura (e dunque se ne consuma meno) e la finitura superficiale è in genere buona. Per esempio, nelle confezioni alimentari, per sostanze poco aggressive (caffè e tabacco), vanno bene film sottili (elettrodeposizione), per elementi più aggressivi (frutta e pesce) o per scatole da inviare in zone tropicali (corrosione filiforme) occorre aumentare lo spessore e si sceglie un deposito più spesso ottenuto per immersione a caldo.
La deposizione chimica (electroless)sfrutta una reazione chimica superficiale per produrre il rivestimento desiderato. L’esempio classico dello spostamento del rame da una soluzione contenente suoi ioni con deposizione sulla superficie di compomente in ferro è istruttivo. A livello industriale, comunque, si impiegano riducenti come l’idrazina, ipofosfiti per accelerare la riduzione dello ione metallico desiderato. In tal modo non è necessario che abbia luogo contemporaneamente un processo di dissoluzione anodica del metallo da rivestire e la reazione procede finchè nel bagno c’è traccia del riducente additivato. In tal modo si possono depositare una grande varietà di metalli, anche su substrati non metallici (argentatura degli specchi). I bagni electroless di questo tipo sono in genere complesssi (brillantanti, emulsionanti, stabilizzanti ecc..).
SMALTI: Gli smalti impiegati nell’industria chimica hanno composizioni particolari in funzione della specifica applicazione (acido-resistenti con composti del boro e con ossidi di titanio e zirconio). Per le applicazioni industriali devono avere coefficienti di dilatazione termica simili al substrato metallico, buona resistenza agli shock termici e buona adesione al metallo (attenzione allo sviluppo di H2; operare con inibitori che limitino la corrosione del metallo e a caldo, per non disciogliere grandi quantità di idrogeno). Problema della difettosità e delle scagliature (difficile riparazione).
STRATI A SPESSORE: I rivestimenti protettivi a spessore, con materiali quali ebanite, gomme, materiali polimerici e bituminosi, hanno un largo impiego nell’industria, e sono utilizzati anche per la protezione di strutture sotterranee e sottomarine. I rivestimenti si effettuano di norma in fabbrica mediante coestrusione, sinterizzazione di polveri ecc.., ma è possibile, per alcuni casi, realizzarli anche in loco mediante applicazione sotto forma di nastri adesivi).
I problemi sono: l’adesione con il substrato metallico, l’invecchiamento e l’infragilimento del rivestimento nel tempo. Nelle applicazioni industriali, bisogna inoltre tenere conto del limitato scambio termico e della relativamente bassa temperatura massima di impiego (max 70 ¸ 80°C).
La distinzione tra vernici e pitture, è nella presenza, in queste ultime, dei pigmenti. La vernice, ha in genere solo una funzione ricoprente, fornendo una protezione di tipo passivo; l’impiego di pigmenti, oltre alla colorazione, può essere specifica di protezione (catodica, anodica o passivante) per cui vanno scelti in modo appropriato. Un normale rivestimento con pittura viene condotto con una o più mani di fondo, con strati che aderiscono bene al substrato (importante è dunque la preparazione della superficie da proteggere: sgrassaggio, decapaggio e sabbiatura) e che svolgano una funzione attiva di protezione, ed uno o più strati di finitura, con l’intenzione di isolare lo strato di fondo (spesso sensibile all’umidità) dall’ambiente esterno.
La natura del veicolo, può essere molto diversa e classificabile, ad esempio, in base al meccanismo di essiccamento, che può avvenire per ossidazione-polimerizzazione (vernici a base di olio di lino, resine alchidiche epossidiche e poliesteri) e per evaporazione (nitrato di cellulosa) oppure per semplice raffreddamento da alta temperatura (vernici con legante catramoso o bituminoso). Vernici a base di acqua sono impiegate nell’industria automobilistica nei bagni elettroforetici.
Molto importante è l’azione dei pigmenti che, in buona parte, svolgono un’azione passivante, in grado cioè di promuovere e mantenere lo strato di passività sul metallo (ad esempio il minio 2PbO-PbO2) o i cromati di Zn e Pb. Come protezione catodica può essere utilizzato lo Zn (percentuali 50 %) (pigmenti catodici).
Sono film superficiali protettivi formati in situ per via chimica o elettrochimica. Possono servire tal quali o come base per vernici. Sono molto impiegati per gli acciai, per l’alluminio e per lo zinco. I più usati sono l’ossidazione anodica, la fosfatizzazione e la cromatazione.
L’OSSIDAZIONE ANODICA è il metodo più diffuso per la protezione dell’alluminio. Consiste per formare per via elettrochimica un film superficiale di ossido di spessore ragguardevole (3 ¸ 30 mm) di buona compattezza e stabilità. Si esegue in due tempi: in una prima fase si induce la formazione e l’accrescimento del film per via elettrochimica impiegando bagni opportuni (ossalico, borico, bicromato e più comunemente solforico) ed eventualmente aggiungendo coloranti, mentre per immersione in acqua bollente, o esposizione al vapore a T = 100 ¸ 150°C, si idrata, si sigilla e si stabilizza il film conferendogli le specifiche caratteristiche protettive ed estetiche.
LA CROMATAZIONE è un processo per la protezione di materiali non ferrosi quali Zn e Cd. Questi metalli, quando usati nella protezione come anodi sacrificali, possono, a seconda dell’ambiente corrosivo, corrodersi velocemente (ambiente marino), e quindi richiedere a loro volta una protezione. Il trattamento consiste nell’immergere il componente in una soluzione acida di cromato, con formazione di prodotti superficiali con caratteristiche protettive. Nel caso dello Zn, il film è spesso pochi micron, trasparente e di colore dal giallo a verde scuro.
LA FOSFATAZIONE consiste nel formare uno strato superficiale sul metallo (in genere ferro) di fosfati misti di Zn, Mn e Fe, fortemente aderente al substrato e ottimo come base per pitture e vernici. L’azione protettiva si esplica nella protezione del materiali nei punti dove la vernice o lo stato organico si sono lesionati a causa della penetrazione dell’umidità, garantendo la presenza del fosfato (inibitore) e inibendo la formazione di focolai corrosivi. Il processo consiste nel trattamento in bagno di acido fosforico e fosfati acidi di Zn e Mn. La reazione con il ferro, con formazione di fosfato primario FeH2PO4 e sviluppo di idrogeno, con consumo di H3PO4, sposta gli equilibri di idrolisi degli altri sali e causa precipitazione sulla superficie. Spesso si impiegano temperature di 50 70°C e acceleranti (ossidanti NO3- ClO3- e H2O2) per sostituire la riduzione di H3O+ e realizzare il processo. Altri impieghi sono la protezione temporanea di componenti metallici da immagazzinare (spessore di fosfato minori di 100mm impiegati come base per successiva pitturazione) oppure il pretrattamento superficiale alle operazioni di formatura di pezzi metallici (fisso il lubrificante, ad esempio stearati ® estrusione, trafilatura).
Supponiamo di accoppiare ad una coppia locale M un materiale a diversa nobiltà (L).
La MACROCOPPIA M-L si sovrappone parzialmente al funzionamento delle coppie locali che costituiscono M, alterando le correnti elettrodiche IA e IC. Se il materiale aggiunto è a funzionamento catodico (più nobile dell'anodo A) allora le correnti sono quelle della figura a fianco ed è verificata la relazione: IA = IC + I; la velocità di dissoluzione dell'anodo è in pratica data dalla velocità IC incrementata della velocità I di funzione della macrocoppia (M-L). Questo significa che per un materiale a comportamento ATTIVO, accoppiare un materiale più nobile comporta un incremento nella velocità di corrosione (Corrosione Galvanica).
La protezione catodica, è una tecnica elettrochimica che viene impiegata per la protezione di metalli in ambienti naturali (cioè non modificabili) aperti, quali il terreno, l’acqua dolce, l’acqua di mare ecc… La principale applicazione riguarda strutture in acciaio, come le tubazioni interrate o quelle in mare dei gasdotti e degli oleodotti, delle piattaforme offshore e delle navi. Si proteggono anche le armature del cemento armato, i serbatoi di stoccaggio corrosivi ecc. Nelle acque naturali, così come in acqua di mare, il ferro si corrode per l’attivazione della riduzione di O2, essendo il suo EREV di circa 0.5 ¸ 0.6 V. Il punto rappresentativo, valido anche per l’acqua di mare, è quello indicato in figura. Partendo di li vi sono diverse opzioni possibili:
Da un altro punto di vista, si può vedere la protezione catodica come il privare di O2 il sottile stato superficiale a contatto con il ferro, essendo la sua riduzione a OH- a carico di un altro metallo o di una corrente esterna. Sono in pratica gli elettroni forniti attraverso il metallo stesso, polarizzato catodicamente, che fungono da oxigen scevenger. Facendo riferimento alle curve di polarizzazione del ferro, si vede che l’intensità di corrente da fornire è proprio la iL dell’O2 che chiaramente dipenderà dalla salinità, agitazione e temperatura ecc… L’entità della iL dipende anche dalla applicazione eventuale di pitture o rivestimenti protettivi, in relazione alle porosità presenti ed alla resistività trasversale.
Dalla seguente tabelle si può notare l’estrema variabilità delle correnti iL da fornire per la protezione del ferro.
TIPO DI SUPERFICIE |
iL |
Superficie nuda in acqua di mare. |
50 ¸ 1000 mA/m2 |
Superficie nuda nel terreno. |
10 ¸ 40 mA/m2 |
Superficie protetta nel terreno. |
10-3 ¸ 0.1 mA/m2 |
In conclusione, la struttura sarà protetta se il suo potenziale sarà portato al di sotto del suo potenziale reversibile, mediante l’applicazione di una fem che polarizzi il metallo. L’EREV-Fe++/Fe rappresenta il valore ottimale di potenziale per cui non si manifesta un’apprezzabile evoluzione di H2. Al di sotto di questo, la corrente catodica è dovuta sia alla riduzione di O2 che di H+. Per cui, se il metallo viene portato a valori molto bassi, diviene preponderante l’evoluzione di H2, e in questo caso si ha sovraprotezione. L’evoluzione di H2 è indesiderata per diversi motivi:
Il potenziale di protezione EPROT = EREV-Fe++/Fe dipende dall’ambiente, e di norma vale circa -0.5 ¸ -0.6 V (SHE). Tuttavia, la presenza di complessanti o di altre specie particolari può variarlo in misura considerevole. Ad esempio, se è presente un’atmosfera di batteri solfato-riducenti, che incrementano [S--] che incrementano il KPS del FeS (minore del KPS del Fe(OH)2), il potenziale reversibile decresce a valori di circa –0.65 V (SHE). Anche tenendo conto di questi fattori, il potenziale di protezione comunemente applicato è intorno a – 0.9 V Cu/CuSO4. Per avere dati più precisi sul potenziale di protezione e sull’entità della reazione catodica con scarica di H2, occorre eseguire prove di polarizzazione simulando l’ambiente reale.
Fonte: HTTP://WWW1.DICCISM.UNIPI.IT/DE_SANCTIS_MASSIMO/CORROSIONE/APPUNTI%20DI%20CORROSIONE.DOC
Sito web da visitare: HTTP://WWW1.DICCISM.UNIPI.IT/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve