I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Studio della combustione
Obiettivo:
Comprendere la trasformazione chimica della combustione e determinare le specie chimiche che cono coinvolte.
Introduzione:
Nei libri di scuola troviamo scritto che la combustione è una reazione chimica veloce che comporta l'ossidazione di un combustibile da parte di un comburente (che in genere è rappresentato dall'ossigeno presente nell'aria), con sviluppo di calore e di gas.
In termini più rigorosi quindi la combustione è una ossidoriduzione esotermica in quanto un composto si ossida mentre un altro si riduce (nel caso degli idrocarburi, il carbonio si ossida, l'ossigeno si riduce) con rilascio di energia e formazione di nuovi composti, principalmente anidride carbonica ed acqua.
Ma come siamo riusciti ad arrivare a questa particolare definizione?
Bisogna tornare molto indietro nel tempo.
La combustione non venne classificata come fenomeno chimico fino alla metà del XVII secolo quando Stahl, un chimico tedesco, era arrivato a trovare un particolare “elemento”, una proprietà dei materiali infiammabili: IL FLOGISTO.
Secondo Stahl, infatti, tutte le sostanze che bruciano erano ricche di flogisto (dal greco: fiamma). Riteneva che i metalli fossero ricchi di flogisto mentre le calci (gli attuali ossidi) ne fossero privi.
Le fasi salienti della sua teoria erano le seguenti:
Attorno alla fine del XVII secolo però alcuni chimici, notate alcune incongruenze fra la teoria di Stahl e i dati da loro raccolti, iniziarono ad interessarsi al fenomeno della combustione.
La prima vera svolta riuscì ad affiorare solo il secolo successivo.
Nel frattempo grandi chimici e fisici come Torricelli, Boyle, Hales, Cavendish, Sheele e Joseph Blach scoprirono importanti concetti. Iniziarono infatti a comprendere che l'aria, che solo dopo Torricelli venne definita come un fluido elastico che esercita una pressione e che non era mai stata presa in considerazione nelle reazioni come soggetto attivo, non era tutta uguale ma aveva diverse proprietà.
Iniziarono a scoprire “arie” differenti e differenti gas che le formavano (azoto, anidride carbonica, idrogeno, ossigeno, cloro..)
Poi, solo alla fine del 1700 fu compreso, da Lavoisier, che l'aria era un soggetto attivo nelle ossidazioni, nella respirazione e nelle reazioni di combustione, e una parte , l’ossigeno , diventava un reagente.
combustibile + comburente --> prodotti + calore
Sempre da Lavoisier erano stati indicati i tre elementi che partecipano alla combustione:
Proporzionabili in queste quantità stechiometriche :
CnH2(n+1) + (3n+1)/2 O2 --> nCO2 + (n+1)H2O + calore
Le prove in cui ci siamo soffermati in questa esperienza sono strettamente collegate ai processi che hanno portato alla definizione di combustione e, quindi ai suoi prodotti e alle sue caratteristiche.
PRIMA PROVA
Abbiamo iniziato le nostre serie di prove con la più semplice ma la più importante:
comprendere che nel processo di combustione viene persa una massa e determinare la proporzionalità che vi è fra il tempo di combustione di una candela e la sua rispettiva perdita di massa.
Materiali e i reagenti occorsi sono:
Parte sperimentale:
Attacchiamo una candela ad un cartoncino per raccogliere la cera che, durante la combustione, potrebbe cadere e alterare il peso.
Pesiamo dapprima la candela spenta.
Poi la accendiamo per un numero di minuti prestabiliti(Fig .1). Al termine di questi la spengiamo e torniamo a pesarla. Riaccendiamo la candela e ripetiamo il procedimento fino ad ottenere un totale di 7 pesate (Fig.2).

Ci accorgiamo che il peso della candela diminuisce a causa delle reazioni che avvengono fra idrogeno, ossigeno e carbonio.
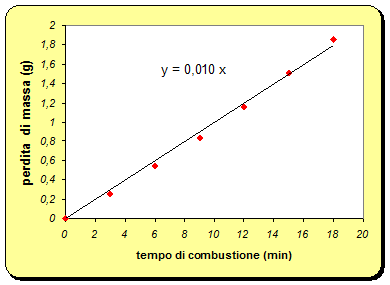
Inoltre calcolando il rapporto fra la perdita della massa e il tempo di combustione notiamo che c'è un rapporto di proporzionalità diretta.

Compiliamo quindi una tabella con i dati ottenuti.
Calcoli:
intervalli di tempo |
tempo di combustione |
massa candela |
perdita di massa |
(minuti) |
(minuti) |
( g ) |
(g) |
|
|
|
|
0 |
0 |
34,82 |
0 |
2 |
2 |
34,65 |
0,17 |
2 |
4 |
34,44 |
0,38 |
2 |
6 |
34,22 |
0,60 |
2 |
8 |
33,99 |
0,83 |
2 |
10 |
33,75 |
1,07 |
2 |
12 |
33,50 |
1,32 |
|
|
|
|



Conclusioni:
Nel processo di combustione abbiamo appurato che si ha una perdita di massa; ciò implica che alcuni, o forse tutti gli elementi coinvolti in questa reazione hanno reagito (la produzione di calore infatti ci dimostra che durante la combustione della candela avveniva una reazione chimica) creando nuovi composti.
Essendosi però modificato il peso della candela, collegandoci alla teoria atomica di Dalton che ci insegna che gli atomi non si distruggono nelle trasformazioni chimiche e che, quindi, non viene modificata la massa fra reagenti e prodotti, possiamo dedurre che dalla combustione si sono liberati dei gas inodori che non siamo riusciti a vedere.
Ragionando sul grafico, invece possiamo riallacciarci allo studio della cinetica chimica di una reazione , che consiste principalmente nella determinazione sperimentale della sua legge cinetica, che lega la velocità di reazione alla concentrazione di uno o più reagenti, la reazione che avviene durante la combustione è la legge cinetica di ordine zero: velocità è indipendente dalla concentrazione dei reagenti.
Si ha oltretutto una proporzionalità diretta (o una linearità) fra la diminuzione di massa e il tempo trascorso.
SECONDA PROVA
Questa seconda prova, assieme alla seguente, ci è servita a identificare quali specie chimiche sono prodotte nella combustione.
Materiali e i reagenti occorsi sono:
Parte sperimentale:
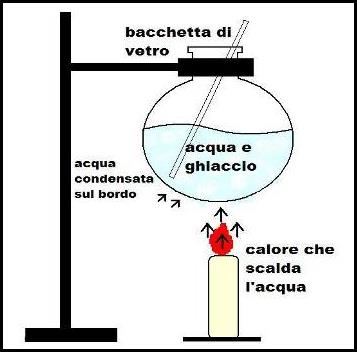
Mettiamo in un ampolla del ghiaccio e poi la fissiamo ad un'asta.
Appoggiamo sotto la nostra ampolla una candela e la accendiamo.
Con una bacchetta di vetro agitiamo continuamente il ghiaccio dentro l'ampolla per mantenere fredde le sue superfici.
Col passare dei minuti notiamo che nel fondo dell'ampolla si forma una condensa di una sostanza trasparente.
Raccogliamo queste piccole gocce di condensa in un vetro da orologio e, per identificarle mettiamo su quest'ultimo un pezzettino di sodio metallico (o elementare) e avviene una reazione fortemente esotermica provocando una scintilla e un po' di effervescenza.
Aggiungendo poi della fenoftaleina nella sostanza liquida rimasta e il colore diventa fucsia / porpora.
Conclusioni:
Quando abbiamo notato la formazione di una condensa nell'ampolla abbiamo intuito che dalla candela stavano salendo vapori prodotti dalla combustione della candela.
Questi vapori, a contatto col le pareti fredde dell'ampolla si erano per l'appunto condensati.
Raccolti e fatti reagire con il sodio abbiamo assistito ad una reazione che, assieme all'aggiunta della fenoftaleina, ci ha consentito di capire che avevamo raccolto acqua.
2H2O + 2Na --> 2NaOH + H2
Abbiamo appurato che è necessario l'ossigeno presente nell'aria per fare avvenire il processo di combustione
Con questa prova siamo riusciti ad identificare due dei tre elementi fondamentali della combustione
(idrogeno e ossigeno).
TERZA PROVA
Abbiamo studiato che per dar luogo ad una combustione sono necessari 3 elementi: (idrogeno, ossigeno e carbonio).
Nella prova , prima siamo riusciti ad identificarne due. Manca ancora il carbonio.
Le informazioni che già abbiamo sono
Facendo una ipotesi possiamo capire che del carbonio, a contatto con l'aria (quindi con ossigeno) reagisce formando anidride carbonica (CO2), e, quindi per riuscire a catturarlo dobbiamo creare un circuito con una “trappola” che lo trattenga. Abbiamo quindi pensato ad un idrossido (quello di bario) che, a contatto con un anidride reagirebbe formando del carbonato di bario e dell'acqua.
Materiali e i reagenti occorsi sono:
Parte sperimentale:
Si collega l'imbuto capovolto e la pompa a vuoto alla beuta dove all'interno c'è Ba(OH)2.
Si accende la pompa che inizia ad aspirare l'aria che passa dalla beuta.
Attacchiamo la candela al cartoncino in modo tale che non perdiamo la cera sporcando il bancone e posizioniamo il tutto sotto l'imbuto, dopo di che accendiamo la candela.
Dopo qualche minuto notiamo che il Ba(OH)2 ha catturato (come una trappola) il prodotto della combustione dando vita ad una soluzione torbida, ricca di precipitato. È avvenuta una reazione fra l'idrossido in questione e il prodotto della combustione.
Filtriamo il tutto raccogliendo, nella carta da filtro, il precipitato e in un becker la soluzione liquida della beuta.
Raccogliamo, dunque, il filtro col precipitato e lo distendiamo sopra il tavolo da lavoro.
Aggiungiamo dell'acido cloridrico (HCl) e notiamo che si sviluppa un'effervescenza , sintomo dello sprigionamento di anidride carbonica (CO2)
Quindi ora possiamo riuscire a scrivere la reazione avvenuta nella prova.
PRIMA REAZIONE (avvenuta dentro la beuta)
Ba(OH)2 + CO2 --> BaCO3 + H2O
precipitato bianco
insolubile in H2O
SECONDA REAZIONE (avvenuta a contatto con HCl)
BaCO3+ 2 HCl --> BaCl2 + CO2 + H2O
La CO2 assorbita viene di nuovo liberata
Conclusioni:
Come abbiamo già detto siamo riusciti a catturare anidride carbonica e, quindi ad identificare l'ultimo dei 3 elementi fondamentali della combustione.
Identificando anidride carbonica abbiamo riconfermato che nella combustione è necessario l'ossigeno
La sostanza restante della filtrazione è leggermente basica probabilmente perché era rimasto ancora un po' di idrossido che non aveva reagito con l'anidride carbonica.
QUARTA PROVA
Questa prova ha a che vedere con un'altra delle conclusioni a cui era arrivato Lavoisier.
Cioè che nella respirazione, nell'ossidazione e nella combustione è sempre necessario l'ossigeno.
Noi abbiamo quindi provato a vedere se, attraverso la respirazione venivano prodotta anidride carbonica (come accadeva nella combustione): ovvero se sia nella combustione che nella respirazione il carbonio si lega con l'ossigeno.
Materiali e i reagenti occorsi sono:
Parte sperimentale:
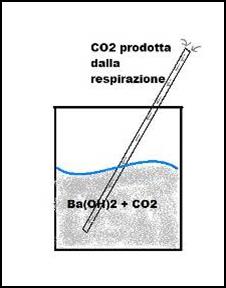
Mettiamo in una beuta idrossido di bario Ba(OH)2 ed inseriamo una cannuccia all'interno del contenitore. iniziamo a soffiare dentro il liquido (quindi a fare reagire i prodotti della respirazione e l'idrossido in questione).
Dopo poco l'anidride carbonica prodotta durante la respirazione reagisce con il Ba(OH)2 formando la stessa soluzione torbida e ricca di precipitato come abbiamo visto nella prova che abbiamo fatto per cercare l'anidride carbonica nella combustione.
Filtriamo la soluzione e appoggiamo il filtro con il precipitato sul bancone. Aggiungiamo l'acido cloridrico notiamo la solita effervescenza avvenuta nella terza prova. questo ci indica lo sprigionamento di CO2.
Conclusioni:
Come detto da Lavoisier sia nella respirazione che nella combustione è necessario ossigeno.
E, come ipotizzato si è ricreata anidride carbonica, quindi sono avvenute le stesse reazioni che nella prova precedente.
QUINTA PROVA
Per assicurarci che l'ossigeno, oltre ad essere un elemento della combustione è anche uno degli elementi di cui non possiamo fare a meno abbiamo fatto una quinta prova.
Abbiamo, riassumendo, fatto reagire tutto l'ossigeno presente in un preciso volume con una candela accesa e osservato cosa accadeva)
Materiali e i reagenti occorsi sono:
Parte sperimentale:
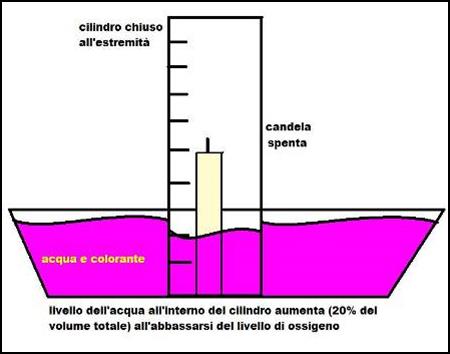
Fissiamo una candela alla base di una vaschetta di plastica che riempiamo fino al bordo di acqua.
Aggiungiamo del colorante che fa diventare l'acqua fucsia e ci permette di visualizzare meglio i risultati dell'esperienza.
Accendiamo la candela e appoggiamo sopra di essa un cilindro graduato capovolto.
Notiamo che mentre la candela brucia il volume dell'acqua dentro il cilindro aumenta.
Dopo pochi secondi la candela si spenge, il volume dell'acqua all'interno del cilindro è circa il 20 % del volume totale.
Conclusioni:
il livello dell'acqua è aumentato per occupare l'ossigeno che è stato consumato durante la combustione.
È aumentato del 20% , ovvero la % di ossigeno presente nell'aria.
Quindi possiamo dedurre che tutto l'ossigeno nel cilindro è stato consumato. Al termine di questa combustione la candela si è spenta perchè, quindi, mancava ossigeno.
Quindi: L'OSSIGENO E' FONDAMENTALE NELLE REAZIONI DI COMBUSTIONE.
SESTA PROVA
In questa prova, invece, vogliamo comprendere cosa può cambiare la presenza di più o meno ossigeno nella fiamma .
Bisogna però approfondire cosa sono e come facciamo a distinguere le varie fiamme del bunsen.
Una fiamma ossidante; come fa intuire la parola, è una fiamma ricca di ossigeno.
Per regolare la fiamma ad ossidante bisogna aprire la valvola del bunsen per fare passare ossigeno.
Questa fiamma si riconosce dal colore blu (4); è una fiamma molto calda. Supera, infatti, i 1200° C
una fiamma riducente, invece, è una fiamma povera di ossigeno.
Per averla, al posto di aprire la valvola dobbiamo chiuderla per non fare passare ossigeno.
La temperatura è nettamente inferiore e il colore non è blu ma giallo (1).
Materiali e i reagenti occorsi sono:
Parte sperimentale:
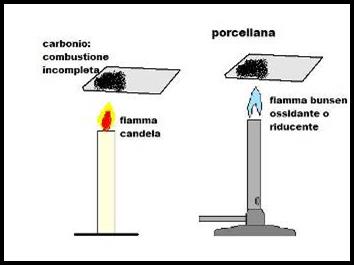 La prova è molto semplice ed articolata in due parti a seconda delle fiamme del bunsen.
La prova è molto semplice ed articolata in due parti a seconda delle fiamme del bunsen.
Nella prima parte facciamo mettere a contatto la fiamma della candela con la porcellana e notiamo che viene a formarsi un velo nero.
Passiamo la stessa porcellana sporcata dalla fiamma della candela sopra la fiamma ossidante del bunsen e notiamo che, dopo qualche secondo il velo nero inizia a scomparire.
Nella seconda parte sporchiamo nuovamente la porcellana con la fiamma della candela. Fatto ciò la passiamo sopra la fiamma riducente del bunsen.
Aspettiamo diversi minuti e notiamo che il velo nero è rimasto uguale.
Conclusioni:
La prima conclusione è che il velo nero, che copre la porcellana quando viene passata sopra la fiamma della candela , è carbonio dovuto ad una cattiva combustione.
Una delle conclusioni a cui siamo arrivati è che, a contatto con la fiamma ossidante , il velo nero scompare , sintomo che il carbonio ha reagito con l'ossigeno formando anidride carbonica.
C + O2 --> CO2
Cercando su internet ho trovato il nome tecnico di questo velo nero e una spiegazione dettagliata.
Il velo è chiamato particolato carbonioso ed è una polvere nera (essenzialmente carbonio più tracce di altri composti) che si può ottenere come sottoprodotto di una cattiva combustione di una qualsiasi sostanza organica.
Lo si può vedere facilmente osservando ad esempio la sottile polvere nera che si forma avvicinando una fiamma ad una superficie metallica fredda come quella di un cucchiaino. Si può comunque trovare facilmente su tutte le superfici esposte a fumi di combustione (ciminiere, condotti di scarico), in particolare in caso di combustione "ricca" di carbonio o comunque povera di ossigeno.
Più nel dettaglio, esso è un agglomerato di particelle carboniose prodotte durante la combustione quando la quantità di ossigeno è insufficiente a bruciare completamente gli idrocarburi in CO2 e acqua (combustione "ricca"), oppure quando la temperatura di fiamma è bassa.
Esistono vari tipi di combustione:
Possiamo notare che man mano che manca l'ossigeno la combustione peggiora.
Passa infatti dal rapporto 1:2 dell'anidride carbonica al rapporto 1:1 del monossido di carbonio (gas inodore e tossico) al rapporto 1:0 del carbonio allo stato elementare
Viene da chiedersi dunque quali sono e perchè non si sono viste le altre sostanze presenti assieme al carbonio..
SETTIMA PROVA
Arrivati alla settima prova, con tutte le informazioni accumulate, iniziamo a chiederci cosa, invece caratterizza la fiamma della candela.
Sappiamo, dal suo colore, che è una fiamma riducente e che quindi brucia sicuramente ad una temperatura minore di 1000° C.
Sappiamo che è una delle maggiori manifestazioni del fatto che stia avvenendo una reazione chimica.
Con questa prova capiremo invece se la fiamma brucia tutta allo stesso modo o se ha zone più o meno calde.
Materiali e i reagenti occorsi sono:
Parte sperimentale:
accendiamo la candela e passiamo il foglio di carta da filtro sopra la fiamma, tenendolo molto fermo e facendolo arrivare alla fiamma dall'alto.
Ritiriamo il foglio dopo meno di due secondi stando attenti che non prenda fuoco.
Notiamo che nel foglio di carta da filtro è rimasta una bruciatura circolare con una zona meno bruciata centrale e, invece, un alone circolare più scuro.
Conclusioni:
Il disegno apparso nella carta da filtro è una netta dimostrazione che la fiamma non brucia tutta allo stesso modo ma, al contrario, ha una parte intera più fredda e una esterna che, a contatto con l'ossigeno brucia.
Questo, oltre a riconfermare che senza ossigeno non c'è combustione, ci pone un'altra domanda: cosa troveremo all'interno della fiamma?
OTTAVA PROVA
In questa prova, come anticipato nella prova precedente cercheremo di capire cosa è contenuto all’interno della fiamma della candela.
Materiali e i reagenti occorsi sono:
Parte sperimentale: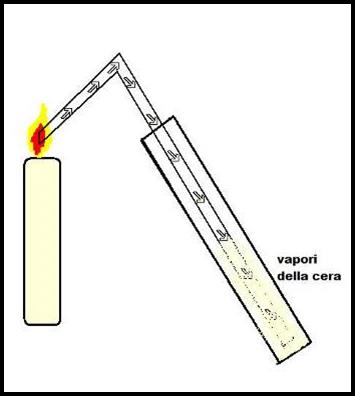
Accendiamo la candela.
Inseriamo nella provetta il tubicino di vetro e lo appoggiamo al centro della fiamma. Aspettiamo uno o due minuti e notiamo che lentamente entrano, dal tubicino ad L, dei vapori bianchi simili
a quelli dell'acqua.
Entrati abbastanza vapori nella provetta , togliamo il tubicino dalla fiammella della candela e continuiamo ad osservare.
I vapori, dopo qualche secondo, si raffreddano e si condensano , creando una leggera patina bianca attorno alle pareti della provetta.
Conclusioni:
I vapori entrati nella candela non possono essere vapore acqueo , perchè, altrimenti, avremmo notato delle gocce d'acqua di condensa.
Escludendo l'acqua e notando il colore bianco della condensa di questo vapore x, possiamo ipotizzare che si tratti di cera e che, quindi, quelli da noi raccolti siano i vapori della cera.
NONA PROVA
Nella nona prova cercheremo di dimostrare che il condensato bianco depositatosi nella provetta nella prova precedente sia veramente cera.
Sappiamo che la cera non si scioglie a contatto dell'acqua quindi utilizziamo del tetracloruro di carbonio.
Materiali e i reagenti occorsi sono:
Parte sperimentale:
Inseriamo nella provetta vuota alcune scaglie di cera e poi ci versiamo dentro del tetracloruro di carbonio. Agitando la provetta, dopo poco notiamo che le scaglie di cera si sono completamente disciolte nel tetracloruro di carbonio.
Abbiamo quindi appurato che la cera si scioglie nel CCl4.
Aggiungiamo, allora, il tetracloruro di carbonio nella provetta coi vapori da identificare e notiamo che la sostanza bianca si scioglie.
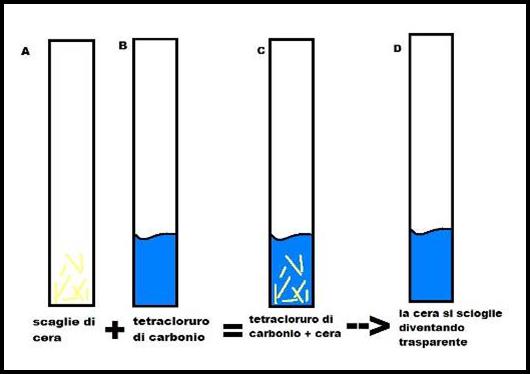
Conclusioni:
E' quindi stato verificato che la sostanza della prova precedente era cera e che proprio quest'ultima si trova nella parte interna della fiamma come vapore .
DECIMA PROVA
Quest'ultima prova è la conclusione, il compimento di tutte le altre prove.
Lo scopo della prova e capire cosa consente alla candela di accenderci.
Materiali e i reagenti occorsi sono:
Parte sperimentale:
l'operazione che faremo è semplice e veloce.
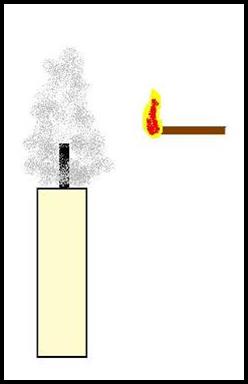
Spegniamo la fiamma della candela con due dita in modo da non far disperdere troppo velocemente i vapori della candela nell'aria e poi avviciniamo un fiammifero acceso allo stoppino.
Ci accorgiamo che la candela si riaccende prima ancora che il fiammifero sia arrivato a toccare lo stoppino.
Conclusioni:
il motivo per cui la candela si accende ancora prima di toccare con una fiamma lo stoppino è che ha ancora intorno i vapori della cera che, a contatto con un innesco (fiamma del fiammifero) iniziano quel triangolo infinito fra
Conclusioni finali:
Con tutte queste prove quindi siamo riusciti ad accertare che:
|
Colore fiamma |
Temperatura in °C |
|
Amaranto pallido |
480 |
|
Amaranto |
525 |
|
Rosso sangue |
585 |
|
Rosso scuro |
635 |
|
Rosso |
675 |
|
Rosso chiaro |
740 |
|
Rosso pallido |
845 |
|
Rosa |
900 |
|
Arancione |
940 |
|
Giallo |
995 |
|
Giallo pallido |
1080 |
|
Bianco |
1205 |
|
Azzurro |
1400 |
Fonte: http://www.itis.arezzo.it
Sito web da visitare: http://www.itis.arezzo.it/documenti/relazione_combustione2.doc
Autore del testo: Zelli Martina
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve