I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
1 . Generalità
Il fenomeno dell'osmosi (dal greco osmòs = spinta), conosciuto in modo superficiale fin dai tempi antichi, pare sia stato messo in evidenza in maniera scientifica nel 1748 dall'abate francese J. A. Nollet, uno scienziato dilettante. Solo un secolo dopo Van't Hoff ha stabilito le leggi che regolano il fenomeno. L'abate Nollet osservò che una vescica di maiale, impermeabile all'alcol etilico, quando veniva riempita di una soluzione idroalcolica e successivamente immersa in acqua pura, tendeva ad assorbire l'acqua dall'esterno gonfiandosi fino a scoppiare.
![]() Applicazioni
Applicazioni
L’osmosi è stata utilizzata anche per lo studio microscopico della membrana cellulare eucariotica. Globuli rossi immersi in acqua distillata variavano la loro morfologia: da disco biconcavo si gonfiavano sempre più fino ad assumere una forma circolare per l’ingresso dell’acqua. La tensione raggiungeva poi un limite massimo oltre il quale la cellula si svuotava completamente del suo contenuto, scoppiando e liberando brandelli di membrana plasmatica, sottili e trasparenti, definiti per questo, col termine inglese “ghost” cioè fantasma.
L’emolisi dei globuli rossi per variazione di pressione osmotica, ancora oggi può permettere di valutare il grado di elasticità della membrana degli eritrociti, compromesso in caso di anemia (es: anemia falciforme).
L'osmosi ha inoltre una grandissima importanza in molti processi fisiologici del nostro organismo, riguardanti specialmente la diffusione del sangue e della linfa, la formazione dell'urina, l'assorbimento enterico degli alimenti, ecc.
Un esempio può essere lo scambio gassoso tra i vasi sanguigni ed i tessuti operato dal sangue.
Il plasma sanguigno è simile, come composizione, al liquido interstiziale che avvolge le cellule dei vari organi; però se ne distingue in quanto nel plasma si trovano le proteine (albumine e globuline). La pressione osmotica esercitata da queste sostanze ha una parte fondamentale negli scambi attraverso la parete dei capillari, in contrasto con la pressione idrostatica.
La pressione osmotica plasmatica (colloidosmotica o oncotica) tende a trattenere e a richiamare l'acqua all'interno del capillare con un'intensità pari a 25 mmHg, mentre la pressione idrostatica agisce in senso contrario e spinge solvente e soluti negli spazi interstiziali. Mentre il valore della pressione osmotica rimane costante nel capillare, in quanto la concentrazione dei soluti non varia, la pressione idrostatica decresce, man mano che il sangue procede nel capillare.
All'estremità arteriosa del capillare la pressione idrostatica pari a 40 mmHg supera la pressione colloidosmotica, pertanto il sangue cede le sue sostanze nutritizie ed i liquidi allo spazio interstiziale con una pressione di 15 mm Hg.
All'estremità venosa, avviene il contrario, in quanto la pressione osmotica risulta maggiore di quella idrostatica pari a 16 mm di Hg, pertanto, per un tratto del capillare, i prodotti della degradazione cellulare verranno trascinati dall'acqua all'interno del capillare stesso con una pressione di 9 mm di Hg.
La quantità maggiore di liquido ceduta dal sangue allo spazio interstiziale verrà successivamente restituita ai vasi sanguigni dal sistema linfatico.
2 . Osmosi
Riferendoci a tali osservazioni possiamo definire l’osmosi come:
il passaggio di un solvente attraverso una membrana semipermeabile in una soluzione allo scopo di diluirla.
E’ un processo fisico spontaneo senza dispendio energetico che dipende dalla concentrazione del soluto in soluzione, cioè più questo è concentrato e più acqua passa attraverso la membrana per diluirlo.
La quantità d’acqua scambiata per osmosi è direttamente proporzionale alla quantità di soluto presente.
L’osmosi, per tale motivo è una delle proprietà colligative delle soluzioni.
Supponiamo di avere due soluzioni a diversa concentrazione separate da una membrana semipermeabile.
Per diffusione il soluto tenderà spontaneamente a spostarsi secondo gradiente cioè dalla zona più concentrata verso quella meno concentrata, ma i pori della membrana non consentono tale passaggio. Eserciterà così una pressione sulla membrana che sarà bilanciata dalla forza opposta dovuta all’ingresso di acqua. Quando si raggiungerà un equilibrio dinamico, l’acqua cesserà di entrare.
La pressione osmotica è quella forza applicata ad una membrana semipermeabile che è bilanciata dalla pressione di diffusione del solvente.
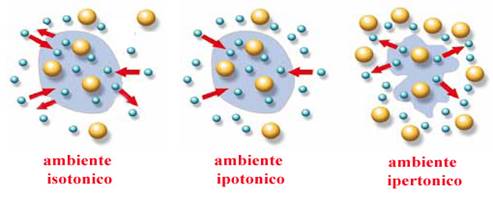
L’ambiente esterno ad una membrana può essere di tre tipi:
Fonte: http://www.ianua.com/patrizia/scuola/file/biologia/osmosi%20e%20pressione%20osmotica.doc
Sito web da visitare: http://www.ianua.com
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve